亮点
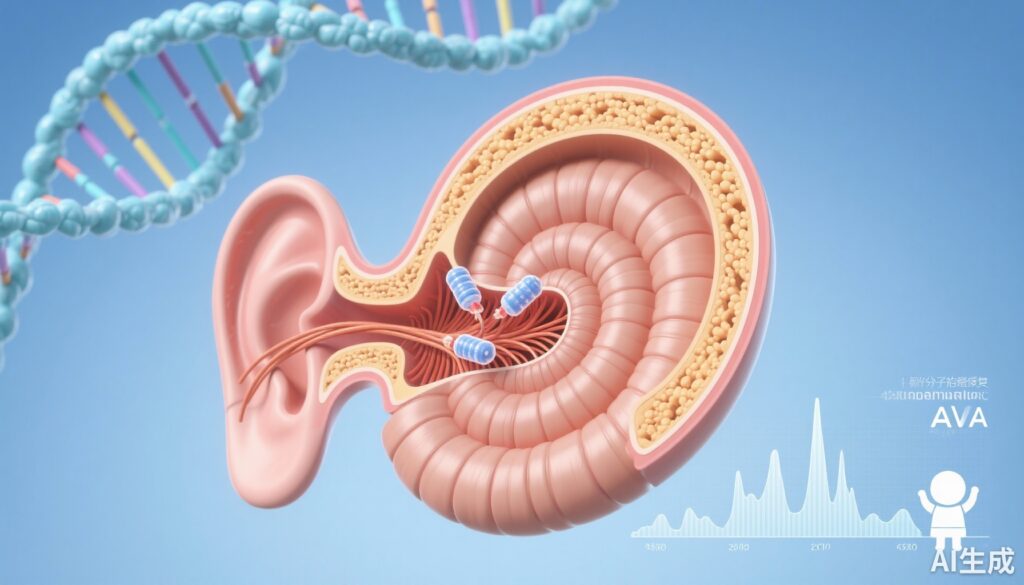
DB-OTO 是一种使用毛细胞特异性合成启动子(mMyo15)的双 AAV1 基因疗法,能够在内耳毛细胞中重组全长人类 OTOF 变异体 5,并在 otoferlin 缺陷小鼠中实现剂量依赖性和持久性的听觉脑干反应(ABRs)恢复,至少持续 3 个月。毛细胞限制性表达对于安全性至关重要,这些临床前数据支持了向儿科 I/II 期临床试验的进展。
背景:临床背景和未满足的需求
OTOF(编码 otoferlin)中的双等位基因功能丧失变异导致 DFNB9,这是一种非综合征性先天性听神经病,其特征是内耳毛细胞(IHCs)与螺旋神经节神经元之间的同步突触传递缺失或严重减少,尽管许多情况下保留了耳声发射。受影响的婴儿通常表现为重度至极重度先天性或早期听力损失,未经干预无法发展出口语。常规管理包括人工耳蜗植入,这可以非常有效,但需要手术和终身设备依赖;此外,它可能无法完全复制自然声音编码以应对复杂的听觉任务。因此,有强烈的理由开发能够恢复缺失的突触前蛋白并可能保留天然耳蜗结构和神经编码的分子疗法。
为 OTOF 开发基因疗法存在特定挑战。Otoferlin 是一种大型多 C2 结构域蛋白(多个外显子编码一个 >6 kb 的编码序列),超过了单个腺相关病毒(AAV)载体的包装能力。递送必须高效且安全地到达 IHCs,表达需要适当细胞限制以避免有害的异位 otoferlin 表达。在小型动物模型中进行临床前概念验证对于评估功能救援和安全性在人类转化前至关重要。
研究设计和方法
Chung 和同事(Mol Ther Methods Clin Dev. 2025)的研究评估了 DB-OTO,这是一种由两个载体组成的双 AAV1 基因疗法,共同重组一个全长人类 OTOF 变异体 5(hOTOFv5)表达盒。一个从鼠类 Myosin 15a 调控元件工程化而来的毛细胞特异性合成启动子(mMyo15),大小约为 1.0 kb,用于驱动 IHCs 中的限制性表达。作者在离体小鼠耳蜗培养物中使用 GFP 报告基因对多个启动子构建体进行了头对头比较,随后在野生型小鼠和食蟹猴中进行了体内验证,以评估转导特异性和向非人灵长类动物的转化。
治疗构建体通过已建立的内耳递送途径递送至新生 Otof 敲除小鼠。研究探索了一个 >10 倍的剂量范围,以评估剂量依赖性和安全性。主要功能终点包括听觉脑干反应(ABRs),这是动物模型中标准的电生理测量指标,用于评估周围听觉通路的功能。分子终点包括 IHCs 中 otoferlin 的免疫组织化学检测以及使用普遍性启动子与毛细胞特异性启动子时的异位表达评估。持久性评估至少持续注射后 3 个月。
关键发现
启动子选择和特异性:多个启动子构建体使用 GFP 报告基因在培养物中筛选。1.0 kb mMyo15 合成启动子在内耳毛细胞中实现了强大的高水平表达,与普遍性启动子相比,脱靶表达最小。在野生型小鼠和食蟹猴中的体内验证显示了毛细胞限制性转基因表达,支持了启动子设计的转化潜力。
全长 OTOF 的重组:双 AAV1 方法成功地在毛细胞中重组了一个功能性的 hOTOFv5 表达盒。两载体系统允许递送超过单个 AAV 容量的编码序列,通过在转导的毛细胞内恢复完整的表达盒。
功能恢复:DB-OTO 在 otoferlin 缺陷小鼠中产生了剂量依赖性的 ABR 阈值恢复。在评估范围内,治疗剂量内的动物显示出建立 ABRs,表明恢复了从 IHCs 到螺旋神经节神经元的突触传递。恢复的程度与剂量和在 IHCs 中观察到的 otoferlin 表达程度相关。
持久性:在测试的剂量范围内,功能性 ABR 恢复和 IHCs 中的 otoferlin 表达至少持续 3 个月。这种持续效应表明在小鼠模型中具有持久的生物学影响,尽管需要更长时间的随访和更大物种的评估来确认持久性。
安全性和启动子的重要性:一个关键的安全发现是毛细胞特异性表达至关重要。与驱动 hOTOFv5 表达的普遍性启动子相比,引发了安全问题,暗示 IHCs 外的异位表达可能是有害的,细胞限制减轻了脱靶效应。在观察窗口内,治疗组未报告脱靶病理或重大不良事件。
转化验证:mMyo15 启动子和 AAV1 衣壳在食蟹猴中产生了毛细胞靶向转导,提供了支持向人类试验转化的数据。
解释和机制见解
Otoferlin 被认为在内耳毛细胞突触处充当钙传感器和膜融合促进剂,支持快速和持续的突触囊泡补充,这是高保真听觉信号传导所必需的。在 IHCs 中恢复 otoferlin 表达应重新建立同步的神经递质释放并改善对声音的神经反应。目前的工作证明了这一机制前提:IHCs 中的 otoferlin 分子恢复与突触功能恢复的电生理证据相关。
双 AAV 方法通过分两次递送治疗盒来解决 OTOF 编码序列过大这一关键技术障碍,这些部分在细胞内重组或重组。这种策略的成功取决于目标细胞的共转导效率和准确重组,这两者在测试剂量下的新生小鼠内耳中似乎是足够的。
临床和转化考虑
这些临床前结果支持了在 OTOF 相关听力损失的儿科患者中启动 DB-OTO 的 I/II 期临床试验。临床医生和试验人员应强调几个转化方面:
- 干预窗口:早期治疗可能是有利的,因为听觉通路和语言发展依赖于早期感觉输入。通过新生儿筛查识别的前语言期患者可能是最佳候选人。
- 递送途径和麻醉:在人类中需要在手术条件下进行耳蜗内或圆窗给药;围手术期安全性和婴儿麻醉需要仔细规划。
- 免疫考虑:预先存在的或治疗诱导的对 AAV1 衣壳的免疫反应可能会影响疗效和重复给药。筛选和管理计划应纳入试验设计。
- 结果测量:虽然 ABR 是一个稳健的电生理终点,但临床试验应包括全面的听力评估(根据年龄允许的行为听力学评估)、言语和语言结果以及患者或家长报告的功能措施,以捕捉有意义的益处。
- 持久性和扩展:小鼠的寿命和免疫反应与人类不同;长期随访和非人灵长类动物数据将提供有关临床环境中持久性和安全性的信息。
局限性和待解决问题
几个限制因素阻碍了小鼠数据直接推断到人类临床获益。首先,人类 IHCs 中的共转导效率和重组率尚未完全表征;内耳大小和结构的差异可能影响载体分布。其次,小鼠中三个月的持久性虽然令人鼓舞,但相对于终生听力需求而言是一个有限的时间尺度。第三,更长时间的安全性,包括潜在的异位表达或载体相关免疫病理,需要持续监测。最后,小鼠中的功能恢复主要通过 ABR 评估;重组 otoferlin 在多大程度上恢复了复杂的听觉处理、双耳听力和婴儿的语言结果尚不清楚,必须通过临床研究来确定。
专家评论
该研究代表了一种深思熟虑的转化进展:理性启动子工程以实现毛细胞特异性,实用的双载体设计以克服尺寸限制,以及包括非人灵长类动物在内的跨物种验证。对于照顾 DFNB9 儿童的临床医生来说,这些数据是迄今为止最直接的临床前证据,表明大型突触前蛋白的基因替代可以恢复周围听觉生理。强调毛细胞特异性表达回答了一个在基因治疗开发中经常被忽视的实际安全问题。
尽管如此,临床医生应告知家庭,早期试验主要评估安全性和生物有效性;口语和现实世界听力功能的恢复只能通过结合发育终点的纵向临床研究来揭示。人工耳蜗植入仍然是有循证依据的选择,具有可预测的结果,应作为共享决策讨论的一部分。
结论和未来方向
DB-OTO 证明了双 AAV 递送全长 hOTOFv5 与毛细胞特异性启动子结合,可以在 otoferlin 缺陷小鼠中恢复并维持听觉生理。毛细胞靶向表达减轻了普遍性转基因表达相关的安全问题。这些临床前数据支持了 OTOF 相关聋病儿科患者的 I/II 期临床试验,并代表了向基于基因的天然耳蜗功能恢复的重要一步。
未来的关键优先事项包括临床队列的长期安全性和有效性监测、针对人类耳蜗解剖的递送方法优化、现实世界听觉和语言结果的评估以及解决预先存在的抗 AAV 免疫的策略。如果临床试验证明具有显著益处和可接受的安全性,DB-OTO 或类似方法可以扩大先天性听觉突触病儿童的治疗选择,减少对假肢设备的依赖并改善发育结果。
资金来源和临床试验注册
Chung 等人承认了论文中描述的机构和赞助商支持。研究结果直接促成了 I/II 期试验的启动;临床医生和家庭应查阅 clinicaltrials.gov 注册和试验特定材料,获取注册标识符和最新的入组信息。
参考文献
1. Chung Y, Koehler SD, Cancelarich S, et al. 功能性和持续性的听觉恢复在 Otoferlin 缺陷小鼠中使用 DB-OTO,一种毛细胞特异性 AAV 基因疗法。Mol Ther Methods Clin Dev. 2025 年 8 月 25 日;33(4):101577。doi: 10.1016/j.omtm.2025.101577. PMID: 41036103;PMCID: PMC12481892。
2. Varga R, Jennings B, Hibbard L, et al. OTOF 中的突变,编码 otoferlin,导致 DFNB9,一种隐性形式的非综合征性耳聋。Nat Genet. 2003;35(3):258–264。(首次鉴定 OTOF 为人类先天性耳聋的原因。)
3. 世界卫生组织。耳聋和听力损失。WHO 事实表。2021 年更新。https://www.who.int/news-room/fact-sheets/detail/deafness-and-hearing-loss (2025 年访问)。