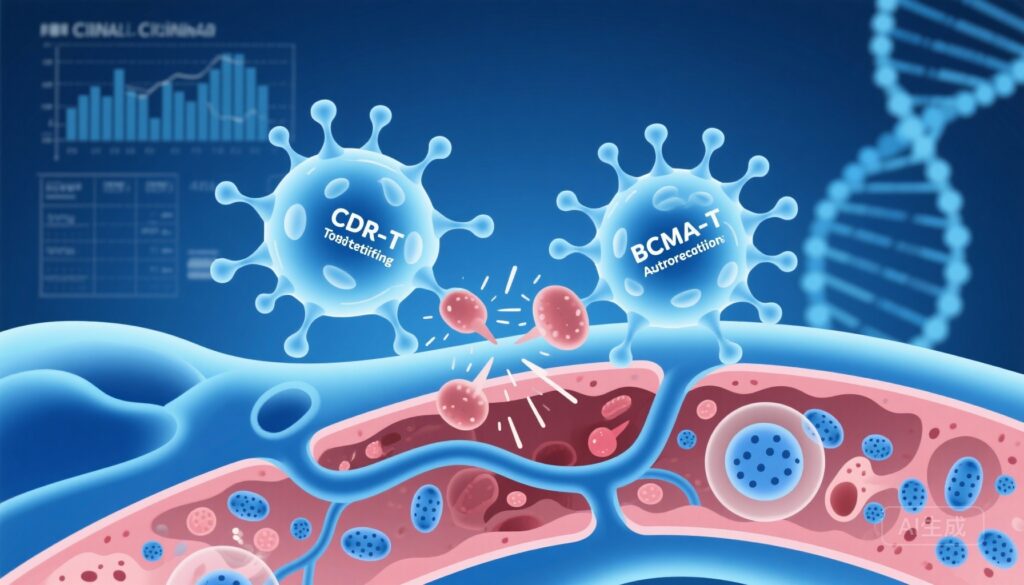
亮点
– 共输注自体抗CD19和抗BCMA的CAR-T细胞在12/15(80%)治疗难治性SLE患者中诱导了LLDAS和DORIS缓解,中位随访时间为712天。
– 未观察到剂量限制性毒性(DLTs)或治疗相关死亡;1级细胞因子释放综合征(CRS)常见(86.7%);≥3级血液学毒性(中性粒细胞减少100%,血小板减少40%,贫血13.3%)通过支持治疗可逆。
– 多组学分析显示消除了自身反应性CD19+和CD19–BCMA+克隆,幼稚IgM/IgD B细胞的重建,以及干扰素刺激和BAFF依赖性特征的持续下调——与恢复免疫稳态一致。
背景:未满足的需求和生物学依据
系统性红斑狼疮(SLE)是一种临床异质性的自身免疫性疾病,由产生自身抗体的B系细胞、免疫复合物形成和I型干扰素途径激活驱动。虽然许多患者对常规免疫抑制和靶向生物制剂(如抗BAFF、抗IFN疗法)有反应,但仍有部分患者对治疗耐药,表现为活动性、器官威胁性疾病和生活质量差。长寿命骨髓浆细胞对许多B细胞耗竭策略具有抵抗性,因为它们通常缺乏CD19(许多疗法的经典靶点),而表达BCMA(B细胞成熟抗原)。相反,循环和组织驻留的自身反应性B细胞表达CD19但不一定表达BCMA。这种区室分离提供了双重靶向的机制依据:CD19以消除CD19+ B细胞区室(包括浆母细胞和记忆B细胞),BCMA以耗竭维持致病性自身抗体产生的长寿命浆细胞。
研究设计
冯等人的报告(《自然医学》2025年)描述了一项正在进行的1期剂量递增试验(ClinicalTrials.gov:NCT05030779),该试验涉及在治疗难治性SLE患者中共输注自体抗CD19和抗BCMA的CAR-T细胞。关键特征:
- 人群:15名患者(14名女性,1名男性),尽管接受了标准治疗,但仍有难治性SLE疾病。
- 干预措施:自体CAR-T制造后进行氟达拉滨/环磷酰胺淋巴清除,并共输注抗CD19和抗BCMA的CAR-T产品(应用剂量递增方案)。
- 主要终点:28天内的剂量限制性毒性(DLTs)和12周内的不良事件。
- 次要终点:12周内达到狼疮低疾病活动状态(LLDAS)和DORIS缓解,以及24周内在体CAR-T的持续性。
- 探索性终点:外周B细胞耗竭和恢复的持续时间和动力学、免疫重建、连续自身抗体滴度和血清免疫球蛋白浓度。
关键发现
安全性
在整个队列中未观察到DLTs,也无治疗相关死亡。细胞因子释放综合征(CRS)发生在86.7%的患者中,但严重程度仅限于1级。值得注意的是,未报告神经毒性。最常见的≥3级不良事件是血液学毒性:100%的患者出现中性粒细胞减少,40%的患者出现血小板减少,13.3%的患者出现贫血;这些事件通过标准支持措施可逆。总体安全性与淋巴清除化疗和CAR-T治疗的预期毒性一致,但重要的是CRS等级较低且无神经毒性,这在这一小规模、重度预处理的自身免疫队列中显得有利。
短期疗效(临床终点)
输注后12周,15名患者中有12名(80%)同时达到LLDAS和DORIS缓解标准。这是一个在耐药人群中令人震惊的信号,特别是考虑到单次细胞治疗后的快速响应。试验报告称,在中位随访时间712天(范围613-1,134天)内持续临床获益,表明超出早期治疗窗口的持久性。
生物相关性和多组学发现
进行了全面的多组学分析以表征响应机制。关键观察结果包括:
- 消除了跨越CD19+和CD19–BCMA+区室的自身反应性克隆,与有效清除循环B细胞和骨髓浆细胞一致。
- 重建了一个以IgM/IgD表型为主的幼稚B细胞池,而不是自身反应性记忆克隆,表明B细胞库的重置。
- 持续下调干扰素刺激基因和BAFF依赖性转录特征,这些特征在活动性SLE中通常上调并与其疾病活动相关。
- 在子集(三名患者随访1年)中纵向监测显示持续清除致病性克隆,提示至少部分患者可能具有治愈效果。
专家解读和机制合理性
共靶向策略解决了SLE治疗中的长期生物学障碍:骨髓中长寿命自身反应性浆细胞的持续存在,这些细胞逃避了CD19定向疗法并继续产生致病性自身抗体。BCMA在浆细胞上高度表达,BCMA靶向模式(包括抗体-药物偶联物和CAR-T细胞)已在浆细胞驱动的疾病中显示出活性。因此,联合CD19/BCMA方法提供了对自身反应性B系细胞库的两方面根除:CD19 CAR-T杀死循环B细胞和浆母细胞,而BCMA CAR-T则针对长寿命、CD19阴性的浆细胞。观察到的幼稚、非自身反应性B细胞库的恢复和干扰素和BAFF特征的正常化与去除狼疮自身免疫的核心驱动因素在生物学上是一致的。
局限性和注意事项
尽管有令人信服的早期结果,但仍需谨慎:
- 1期,非随机,小样本:该研究旨在评估安全性和信号疗效,但不足以提供与标准护理或其他靶向药物的比较有效性。
- 选择和中心效应:选择标准、既往治疗、器官受累和中心经验的细节将影响普遍性。
- 感染风险和低丙种球蛋白血症:深刻B细胞和浆细胞耗竭的长期后果包括低丙种球蛋白血症和感染易感性。报告中提到免疫球蛋白监测,但更广泛的感染结局和替代免疫球蛋白的需求需要在更大样本中进行系统的随访。
- 成本、复杂性和可及性:自体CAR-T制造、淋巴清除和专门的支持治疗目前在可扩展性方面受限,相比之下传统生物制剂更为便捷。
- 持久性和复发:尽管中位随访时间较长(712天),并且部分患者显示1年的致病克隆清除,但需要在更多患者中进行更长时间的随访,以确定实现持久、无治疗缓解或“治愈”的患者比例。
临床和研究意义
这些结果提供了概念验证,证明细胞疗法可以在难治性SLE中重置自身免疫。实际意义包括:
- 患者选择:高风险病态的真正难治性患者可能优先考虑早期细胞治疗试验;生物标志物(自身抗体特异性、骨髓浆细胞负荷、BAFF/IFN特征)可以帮助选择最有可能受益的患者。
- 监测和支持治疗:未来协议应标准化抗菌预防、免疫球蛋白替代、疫苗接种时机和长期B细胞重建监测的方案。
- 试验设计:需要随机对照的2/3期研究来比较双CAR-T与最佳可用疗法,优化剂量,并评估持久性、生活质量、器官特异性结局和成本效益。
- 机制研究:连续多组学分析可以识别持久缓解与复发的相关因素,并指导个性化维持策略(例如,如果最小残留自身反应性持续存在,则使用靶向生物制剂)。
结论
共输注自体抗CD19和抗BCMA的CAR-T细胞在治疗难治性SLE患者的1期队列中显示出有利的安全性和有希望的临床疗效,早期缓解率高,且有生物证据表明致病性B系细胞克隆的清除。数据支持进一步开发和更大规模的对照试验,以确定这种方法是否可以为难治性SLE患者提供持久、可能治愈的选项。随着领域的发展,必须仔细关注长期感染风险、免疫球蛋白替代策略和公平可及性。
资金和试验注册
报告在原始出版物中包含资金和机构支持详情。ClinicalTrials.gov标识符:NCT05030779。
参考文献
- 冯J, 霍D, 洪R, 等. 抗CD19和抗BCMA的CAR-T细胞共输注治疗难治性系统性红斑狼疮:1期试验. 《自然医学》. 2025年9月24日. doi:10.1038/s41591-025-03937-8. PMID: 40993243.
缩略图提示(AI图像生成)
一个风格化的临床科学插图,展示两个工程化的CAR-T细胞(一个标记为抗CD19,一个标记为抗BCMA)在人体淋巴结和骨髓示意图中结合并清除自身反应性B细胞和浆细胞;包括微妙的医疗图表叠加和背景中的DNA双螺旋;冷临床蓝色/蓝绿色调,高细节,信息丰富且现代。