亮点
1. 在一项多中心前瞻性研究中,1,351名患者在钆增强3-T MRI上显示,环形动脉瘤壁强化(AWE)与四年内36.8%的绝对累积不稳定性(生长或破裂)风险相关。
2. 与局灶性AWE(17.2%)或无AWE(11.4%)相比,未破裂颅内动脉瘤(UIAs)中的环形AWE表现出显著更高的不稳定性风险。
3. 调整传统风险因素(如大小比、位置和形状)后,环形AWE仍然是不稳定的独立预测因子,调整后的风险比为2.21。
4. 这些发现支持将MRI血管壁成像(VWI)纳入常规临床工作流程,以识别可能需要更积极干预的高风险未破裂颅内动脉瘤。
背景和临床背景
未破裂颅内动脉瘤(UIAs)的管理是神经外科和介入神经放射学中最具挑战性的难题之一。尽管普通人群中UIAs的患病率估计约为3%,但只有少数会破裂。然而,蛛网膜下腔出血(SAH)的后果是毁灭性的,死亡率和长期发病率都很高。历史上,临床医生依赖于形态学和人口统计学因素——编码在PHASES或ELAPSS评分系统中——来估计破裂风险。这些因素包括动脉瘤大小、位置、患者年龄和既往SAH史。
然而,仅靠形态学往往无法捕捉动脉瘤壁内的生物学活动。越来越多的证据表明,慢性炎症、动脉粥样硬化和动脉瘤壁内的血管生成是不稳定性的真实驱动因素。钆增强磁共振成像(MRI)的动脉瘤壁成像,也称为血管壁成像(VWI),已成为一种有前景的非侵入性工具,用于可视化这些病理过程。虽然早期回顾性和小规模纵向研究表明动脉瘤壁强化(AWE)与不稳定性相关,但由于缺乏大规模、长期的前瞻性数据,其在标准临床指南中的应用受到限制。刘等在《美国医学会杂志·神经病学》上发表的研究填补了这一空白,提供了关于AWE在四年期间预测价值的有力证据。
研究设计和方法
该研究利用了2017年1月至2024年12月在中国83个中心进行的三项前瞻性多中心队列研究的个体患者数据。纳入标准针对18至75岁且至少有一个无症状、囊状UIA(直径3毫米或更大)的患者。共有1,453名患者接受了基线3-T MRI和钆增强动脉瘤壁成像及计算机断层扫描血管造影(CTA)。排除失访或影像质量低的患者后,最终分析包括1,351名患者的1,416个UIAs,代表了4,884个动脉瘤年的随访。
主要暴露因素是基线时AWE的模式,分为三组:环形AWE(整个壁强化)、局灶性AWE(部分强化)和无AWE。主要结局指标是动脉瘤不稳定性,定义为记录的生长(任一维度增加1毫米或更多)或自发破裂。随访使用CTA评估这些变化。研究人员采用Kaplan-Meier估计法确定绝对风险,并使用Cox比例风险回归计算风险比(HRs),调整已知的混杂因素,如大小比、动脉瘤位置、形状(规则与不规则)和分支配置。
主要发现和统计分析
队列的中位年龄为56岁,56%为女性。在4年随访期内,1,416个UIAs中有235个(16.6%)出现不稳定性。数据显示,壁强化的程度与未来不良事件的风险之间存在明显的剂量-反应关系。
绝对和累积风险
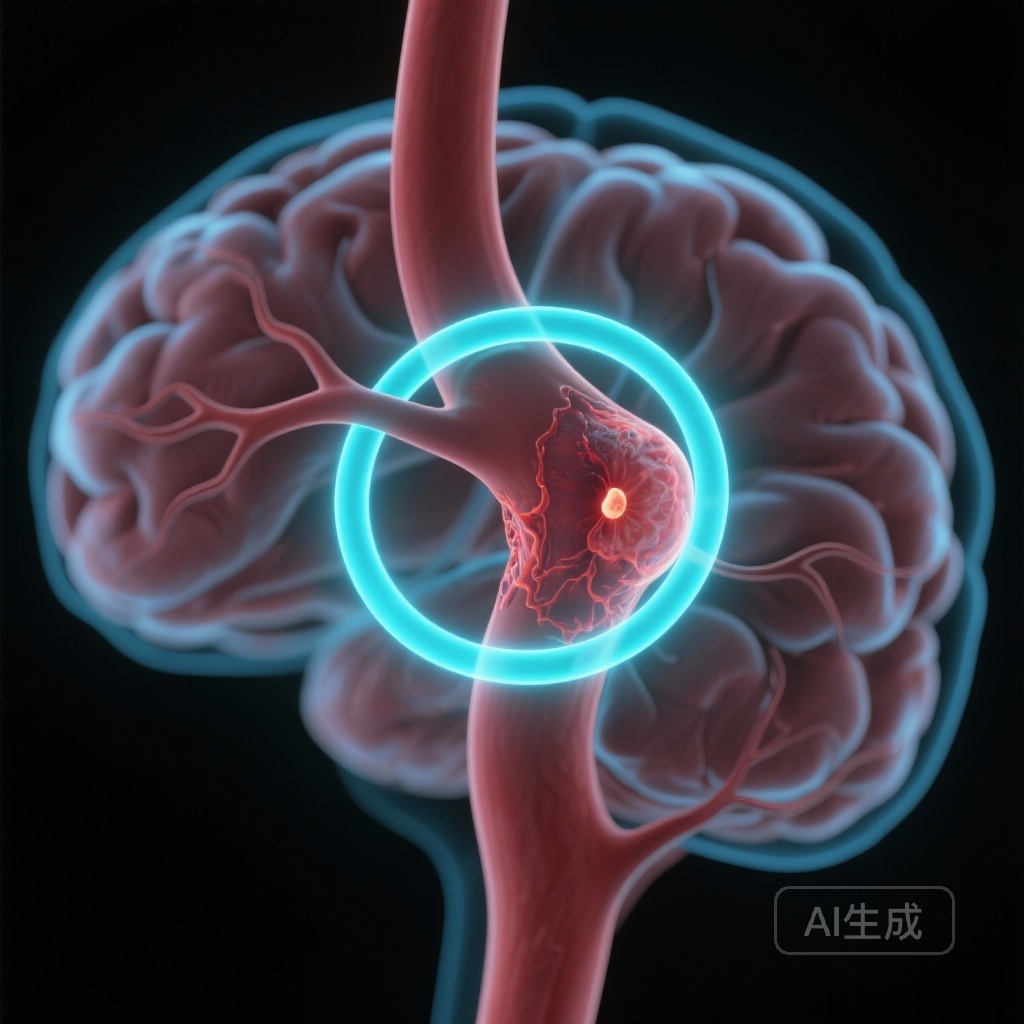
4年时,环形AWE组的绝对累积不稳定性风险明显更高。具体而言,36.8%(95% CI, 30.7%-43.0%)的环形AWE UIAs变得不稳定。相比之下,局灶性AWE的风险为17.2%(95% CI, 13.4%-21.1%),无AWE的风险为11.4%(95% CI, 11.9%-16.1%)。这表明超过三分之一的环形强化动脉瘤将在四年内生长或破裂。
预测价值和风险比
在未调整模型中,环形AWE与不稳定性风险几乎增加四倍相关(HR, 3.80;95% CI, 2.82-5.14)。关键在于,即使在调整传统形态学预测因子(如大小比、动脉瘤位置和形状不规则性)后,环形AWE仍然是一个显著的独立预测因子(调整后的HR, 2.21;95% CI, 1.56-3.13)。这表明AWE提供了形态学本身无法提供的独特生物学信息。
专家评论和机制见解
AWE作为不稳定性标志物的生物学合理性基于组织病理学研究。MRI上的强化被认为反映了由于内皮功能障碍、通透性增加和炎性细胞浸润(如巨噬细胞和T细胞)导致的钆渗漏到动脉瘤壁。此外,血管生成——壁内的小血管——与壁增厚和随后的强化有关。这些病理变化削弱了内弹性层和中层的结构完整性,使动脉瘤易于扩张或灾难性破裂。
局灶性和环形强化之间的区别特别值得注意。局灶性强化可能代表局部动脉粥样硬化斑块或组织血栓,而环形强化可能表明整个动脉瘤囊内的系统性和更激进的炎症状态。这项研究证实,环形强化是最具临床相关性的表型,用于风险分层。
然而,必须考虑几个局限性。首先,该研究完全在中国人群中进行;尽管结果令人信服,但仍需在西方队列中进一步验证,以考虑潜在的遗传和环境差异对动脉瘤自然史的影响。其次,尽管该研究使用了3-T MRI,但不同制造商和中心之间的VWI具体协议可能有所不同,强调在将AWE正式纳入国际指南之前需要标准化成像参数。
临床意义和未来方向
刘等的研究结果对UIAs的临床管理具有直接意义。多年来,“尺寸阈值”(通常为5毫米或7毫米)一直是治疗决策的主要驱动力。然而,临床上经常遇到小动脉瘤破裂和大动脉瘤数十年保持稳定的情况。MRI壁成像提供了一种向更加个性化、“精准医学”方法发展的途径。
即使低于传统干预的尺寸阈值,如果显示环形AWE,动脉瘤也应被视为具有更高的可疑性。相反,较大动脉瘤中无AWE可能会为继续观察提供一些安慰,但不应成为决定不治疗的唯一因素。随着技术变得更加普及,VWI可能会成为所有UIAs初始评估的标准辅助手段。
结论
总之,这项大规模前瞻性研究确立了环形动脉瘤壁强化作为UIA不稳定的强大、独立影像学生物标志物。环形AWE在四年内有36.8%的生长或破裂风险,识别出可能受益于早期手术或血管内治疗的高风险亚组患者。这项研究代表了我们在预测颅内动脉瘤自然史方面的重要进展,最终减少蛛网膜下腔出血的负担。
参考文献
1. Liu Q, Nie X, Vergouwen MDI, et al. Gadolinium-Enhanced Aneurysm Wall Imaging and Risk of Intracranial Aneurysm Growth or Rupture. JAMA Neurol. 2025;82(11):1135-1143. doi:10.1001/jamaneurol.2025.3209.
2. Mossa-Basha M, de Havenon A, Becker KJ, et al. Added Value of Vessel Wall Magnetic Resonance Imaging in the Management of Intracranial Aneurysms. Stroke. 2019;50(1):211-217.
3. Vergouwen MDI, Backes D, van der Schaaf IC, et al. Predictors of Aneurysm Growth and Rupture: A Systematic Review. Stroke. 2017;48(10):2859-2861.