最近,Nature Reviews Drug Discovery盘点2025年美国FDA药物评估与研究中心(CDER)批准了46种新治疗药物。
这一数字使得五年平均获批量略微下降,达到每年48种新药。但批准数量仍远高于自1993年以来每年36种新药的历史平均水平。
CDER新获批情况,来源FDA
2025年,美国食品药品监督管理局(FDA)药品评估与研究中心(CDER)批准了46种新型治疗药物。虽然这一数字较过去五年平均每年48个批准有所下降,但仍显著高于自1993年以来记录的长期历史平均每年36个批准。这一数量反映了即使在面对波动的监管和政治气候时,制药行业仍在不断推动分子生物学的边界。对于临床医生和研究人员来说,2025年标志着一个关键的一年,其特点在于已建立药物类别的多样化、慢性疾病的首创新机制的出现,以及向以患者为中心的给药方法的转变。
2025年批准周期的亮点
2025年的治疗领域由几个关键趋势主导:
1. 肿瘤学仍然是创新的主要驱动力,占所有新批准的35%。
2. 第100个激酶抑制剂雷米布替尼的批准,标志着该类别扩展到非肿瘤学适应症。
3. 非阿片类止痛管理和慢性呼吸系统疾病通过首创新机制取得重大突破。
4. 重大的监管重组和有争议的审查路径的引入,例如专员国家优先权凭证(CNPV)。
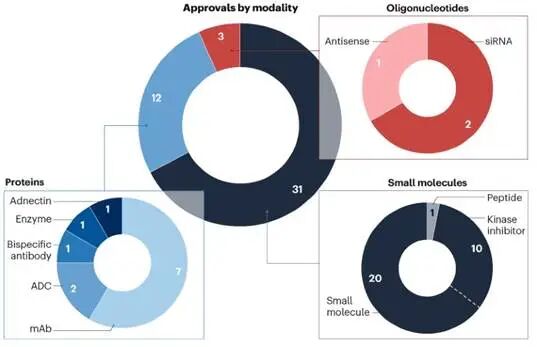
按治疗方式划分的CDER获批情况,来源:《自然综述.药物发现》。
肿瘤学:从输注到创新
肿瘤学继续是药物开发最活跃的领域。在46个批准中,有16个专门用于癌症治疗。然而,重点已经从发现全新的靶点转向改进现有的重磅炸弹药物和推进抗体-药物偶联物(ADCs)。
帕博利珠单抗的演变
2025年的突出批准之一是默克公司的帕博利珠单抗(Keytruda)皮下制剂与贝拉海藻酸酶α联合使用。自2014年首次批准以来,帕博利珠单抗已成为免疫肿瘤学的基石。新的皮下给药系统利用贝拉海藻酸酶α——一种重组人透明质酸酶——暂时降解皮下组织的细胞外基质,促进大体积生物制品的吸收。这种制剂有望通过将治疗从长时间的静脉输注转变为快速注射,显著减轻患者的治疗负担和医疗系统的压力。分析师预测,这种皮下版本的销售额可能达到93亿美元,确保其成为顶级收入来源。
ADCs的崛起和PD-L1的多样性
ADC领域迎来了datopotamab deruxtecan(Dato-DXd)的批准,这是一种针对激素受体阳性、HER2阴性乳腺癌的TROP2导向药物。这一批准进一步验证了ADC平台能够以高精度递送强效细胞毒性有效载荷的能力。此外,随着penpulimab(Akeso Biopharma)的批准,获批的PD-(L)1抑制剂总数达到了12个,表明这是一个高度竞争但成熟的市场。
满足未满足的需求:呼吸系统和疼痛管理
除了肿瘤学,2025年还带来了两项重要的‘首创新类别’批准,解决了临床实践中的重要空白:支气管扩张症和急性疼痛。
布伦索卡替布:支气管扩张症的新范式
几十年来,非囊性纤维化支气管扩张症的治疗仅限于气道清除和抗生素。Insmed的布伦索卡替布是一种二肽基肽酶1(DPP1)抑制剂,是首个针对该疾病基本病理生理学的药物。通过抑制DPP1,该药物可以防止骨髓中中性粒细胞成熟过程中中性粒细胞丝氨酸蛋白酶(NSPs)的激活。肺部高水平的NSPs与支气管扩张症的炎症和组织损伤有关。临床数据显示,布伦索卡替布可以减少肺部急性加重的频率,为美国约50万患有这种致残性疾病的患者带来了新的希望。
苏泽特里吉:追求非阿片类止痛药
Vertex的苏泽特里吉(VX-548)的批准标志着寻找有效非阿片类镇痛药的数十年努力的一个里程碑。苏泽特里吉是一种选择性的电压门控钠通道NaV1.8抑制剂。与之前试图靶向NaV1.7但未能在临床试验中成功的尝试不同,靶向NaV1.8已被证明可以在周围神经系统中阻断疼痛信号,而不会产生与阿片类药物相关的中枢神经系统副作用。尽管其姊妹分子VX-993在同年晚些时候的II期试验中失败,苏泽特里吉仍作为精准镇痛的概念验证。
扩大激酶和PDE4抑制剂的用途
2025年还见证了已建立的药物类别向新适应症的‘转型’。雷米布替尼(Rhapsido)用于慢性自发性荨麻疹的批准标志着第100个FDA批准的激酶抑制剂。这种布鲁顿酪氨酸激酶(BTK)抑制剂突显了BTK类别从B细胞恶性肿瘤向自身免疫和炎症性疾病的转变。同样,rilzabrutinib也被批准用于免疫性血小板减少症。
在呼吸系统领域,勃林格殷格翰的nerandomilast成为首个被批准用于特发性肺纤维化(IPF)的磷酸二酯酶4(PDE4)抑制剂。虽然PDE4抑制剂长期以来一直用于慢性阻塞性肺病(COPD)和银屑病,但nerandomilast对PDE4B亚型的选择性使其能够调节肺部的纤维化途径,提供了十多年来首个新的IPF治疗选择。
新型模式:Affibodies和脂质管理
2025年的创新不仅限于小分子和单克隆抗体。LIB Therapeutics获得了lerodalcibep的批准,这是一种基于affibody技术的PCSK9抑制剂。Affibodies是小而高度稳定的蛋白质,充当抗体模拟物。Lerodalcibep提供了一种小体积、每月一次的皮下注射,可在室温下储存,为现有的PCSK9单克隆抗体提供了一种更方便的替代品。这一批准反映了开发‘下一代’生物制品的更广泛趋势,这些生物制品改善了第一代疗法的药代动力学和存储特性。
监管环境:动荡与透明度
尽管药物管线保持生产力,但FDA内部环境却动荡不安。在Robert F. Kennedy Jr.被任命领导卫生与公众服务部后,CDER和CBER部门的工作人员流失率接近18%。CDER在一年内更换了五位主任。
尽管存在这种不稳定性,FDA还是推出了专员国家优先权凭证(CNPV)试点计划。该计划旨在将关键药物的审查周期从10-12个月缩短至仅2个月。然而,该计划遭到了内部员工和监督团体的批评,他们担心加速的时间表可能会使审批过程政治化并危及安全标准。
为了提高透明度,FDA还开始发布编辑过的完整回复信(CRLs),详细说明为何药物申请被拒绝。这为科学界提供了宝贵的见解,了解药物开发中的陷阱,如apitegromab因制造问题被拒绝,vusolimogene oderparepvec因试验设计异质性被拒绝。
2026年展望:靶向蛋白降解的时代
展望2026年,医学界密切关注Arvinas和辉瑞公司开发的vepdegestrant的进展,这是一种用于乳腺癌的PROTAC(蛋白水解靶向嵌合体)。如果获得批准,它将成为市场上首个靶向蛋白降解剂。与传统抑制剂仅阻断蛋白质功能不同,PROTACs通过细胞自身的蛋白酶体标记目标蛋白进行降解。这种模式有可能克服当前疗法中的耐药机制,并可能打开靶向‘不可成药’蛋白质的大门。
结论
2025年的FDA批准情况展示了制药行业的韧性及其在监管逆风下提供有意义临床进展的能力。从第100个激酶抑制剂的里程碑到NaV1.8作为可行的疼痛靶点的诞生,今年批准的疗法为临床医生提供了更加精细和强大的工具包。随着我们进入2026年,重点可能仍然放在通过更好的给药系统提高患者便利性和探索蛋白质降解和分子胶的巨大潜力上。
参考文献
1. Nature Reviews Drug Discovery. (2026). FDA drug approvals in 2025. Nature Reviews Drug Discovery, 25(1), 5-12.
2. U.S. Food and Drug Administration. (2025). Novel Drug Approvals for 2025. CDER Reports.
3. Insmed Incorporated. (2025). Clinical efficacy of brensocatib in bronchiectasis: Results from the ASPEN Phase 3 trial.
4. Vertex Pharmaceuticals. (2025). Suzetrigine (VX-548) for the treatment of acute pain: A summary of pivotal trials.