引言和背景
睡眠、昼夜节律与阿尔茨海默病(AD)之间的关系已成为老龄化研究中的主要关注点。睡眠障碍在老年人中很常见,并且经常先于认知衰退和显性痴呆。越来越多的观察性和机制研究表明,这种关系是双向的:神经退行性变化扰乱了睡眠和昼夜系统,而睡眠障碍可能会加速与AD相关的病理生理过程。然而,由于不同研究中方法的高度变异性——不同的问卷、不同的动态记录仪持续时间和处理方式、混合使用多导睡眠图(PSG)和新兴可穿戴设备——使得综合分析困难,减缓了转化进程。
为了应对这一问题,国际阿尔茨海默病研究和治疗学会(ISTAART)的睡眠与昼夜节律专业兴趣小组召集了国际专家,采用改良的德尔菲过程,制定了研究导向的共识建议。这些发现发表在André等人的“关于衰老和阿尔茨海默病中睡眠与昼夜节律研究的国际建议:一项德尔菲共识研究”(Alzheimers Dement. 2025)中,为未来该领域的研究设定了务实、研究导向的最低标准[1]。
为什么现在这些建议很重要
– 睡眠和痴呆症研究的快速增长,加上消费者级和研究级可穿戴设备的激增,使协调方法变得紧迫。
– 跨队列更好的可比性将加强关于睡眠障碍是否以及如何增加AD风险的推断,以及针对睡眠的治疗是否可以预防或减缓认知衰退。
– 这些建议旨在提高数据质量、报告一致性并优先解决关键未解问题——这是向临床试验和最终临床实践指南迈出的重要步骤。
新指南亮点
Delphi共识(André等人)的主要建议和主题是:
– 尽可能使用客观测量方法:PSG/EEG用于标准睡眠结构和微观结构;动态记录仪用于多夜、实际生活中的休息-活动和小睡评估。
– 定义动态记录仪的最短和理想记录时间:避免<7天;最低标准7–13天;理想≥14天。
– 总是将动态记录仪与睡眠日记结合使用,以提高解释和数据质量。
– 避免单一项目的自我报告睡眠问题;重新验证常见的问卷,或开发老年特异性工具。
– 优先使用研究级(经过验证、可访问原始数据)设备;在老年和认知受损人群中验证之前,谨慎解释消费者设备输出。
– 记录标准化的最小数据集(核心变量)和核心加数据集(强烈推荐),包括生物标志物状态和APOE ε4。
– 优先考虑纵向设计、多夜监测、机制EEG分析(频谱分析、连通性、慢波和纺锤波)以及睡眠和昼夜干预的临床试验。
对临床医生和研究人员的关键启示
– 对于专注于老龄化和AD的研究,强调客观、多夜测量和严格报告参与者特征和药物。
– 使用消费者设备时,除非设备有同行评审验证并提供原始数据进行分析,否则将其视为探索性的。
– 需要进行试验,测试治疗睡眠障碍是否显著改变认知轨迹和AD生物标志物;专家组优先考虑此类试验。
更新的建议和与先前实践的关键变化
背景:在此之前,关于可穿戴设备使用和睡眠指标的声明虽然在增长但分散;然而,没有专门针对老龄化和AD研究的国际、研究导向的共识。
在这次共识中有什么新的或明确的内容(与之前的非正式实践相比):
– 睡眠-AD研究中参与者的标准化最小数据集(核心和核心加项目)(见下文方框)。以前的研究通常只报告年龄和性别;共识要求报告额外的共病、药物类别和特定的睡眠诊断。
– 明确的动态记录仪最短和理想记录时间(最少7天,理想≥14天),以及强烈建议将动态记录仪与睡眠日记结合使用——这正式化了一种之前差异很大的做法。
– 明确区分研究级和消费级可穿戴/近身设备,并声明在老年人和认知受损人群中测量有效性的置信水平。
– 优先排序未来研究的睡眠/昼夜特征:昼夜节律、阻塞性睡眠呼吸暂停(OSA)、REM睡眠指标、EEG连通性和频谱分析、动态记录仪的协调、失眠、小睡、睡眠片段化、纺锤波和N3/慢波睡眠。
– 研究环境中PSG/EEG的实用电极位置优先(F3, F4, C3, C4, O1, O2突出)以帮助EEG数据收集的协调。
推动更新的证据
– 可穿戴EEG、多传感器动态记录仪和消费者追踪器的快速改进和更广泛的可用性促使专家组明确区分设备类别,并建议在老年人中进行验证工作[10,11]。
– 关于慢波活动、淋巴功能和淀粉样蛋白动力学的机制研究(例如,Ju等,Mander)支持优先考虑N3/慢波和定量EEG特征[6,8]。
– 专家组优先考虑纵向证据和干预试验,因为目前的观察性关联(例如,睡眠片段化或OSA与认知衰退之间的关联)无法证明因果关系;需要试验来测试风险的修改。
按主题的建议
以下是共识建议和研究人员的实际指导的按主题合成。
1) 核心和核心加参与者数据(需要收集和报告的内容)
核心(强制):
– 认知诊断(正常、前临床AD、轻度认知障碍、AD痴呆)和标准化认知测量。
– 教育水平。
– 体重指数(BMI)。
– 主要共病:神经系统疾病、抑郁症状/精神障碍、心血管疾病。
– 酒精摄入和当前轮班工作状态。
– 睡眠相关诊断和治疗:失眠症状、OSA诊断和OSA治疗状态、不安腿综合征。
– 药物类别:苯二氮卓类、非苯二氮卓类催眠药(Z类药物)、抗抑郁药、其他催眠药(例如,双重食欲素受体拮抗剂、拉莫特隆)、曲唑酮、抗精神病药。
核心加(如果可用则强烈推荐):
– 生物标志物概况(使用CSF或PET或经验证的血浆生物标志物检测的淀粉样蛋白、tau蛋白、神经退行性标志物)。
– APOE ε4基因型。
理由:这些项目解决了睡眠和认知的常见混杂因素/修饰因素,报告它们提高了研究间的可比性。
2) 测量模式及其使用时机
多导睡眠图(PSG)/EEG:
– 优先用于标准睡眠结构和微观结构测量(例如,睡眠阶段、唤醒、频谱功率、慢波特征、纺锤波)。
– 前临床AD和MCI中实验室和经验证的家庭PSG/EEG都是可接受的;对于AD痴呆,家庭PSG/EEG通常是首选,以最大化生态效度和耐受性。
– 推荐的电极优先顺序(超过40%的专家组成员支持):F3, F4, C3, C4, O1, O2(如可行,可添加Cz, Fz, Pz等额外导联)。
动态记录仪/加速度计:
– 推荐用于多夜监测休息-活动模式和白天小睡。
– 最少推荐记录时间:7–13天;理想:≥14连续天。
– 需要同时使用睡眠日记以捕捉睡眠时间、小睡、咖啡因/酒精/药物使用和主观干扰;日记也有助于质量控制和时间段选择。
– 数据处理:推荐使用经过验证的算法,结合软件实现的方法和内部方法,并明确报告评分阈值和使用的算法。
自评和知情者报告:
– 避免依赖单一项目的提问;标准验证的问卷(例如,PSQI, ISI)应在老年人群和认知障碍患者中重新验证。
– 对于前临床AD,患者自评可能是有信息的;对于MCI和AD痴呆,知情者报告通常提供更好的可靠性,但应记录知情者的认知状态。
可穿戴设备和近身设备(EEG头带、智能手表、戒指、床垫传感器):
– 区分研究级设备(经过验证、可访问原始数据、必要时有监管批准)和消费级设备(黑盒算法、专有评分)。
– 强烈建议:优先使用研究级设备,并在使用消费级设备输出作为主要终点之前,在老年人和认知受损人群中进行验证。
– 尽可能将基于EEG的可穿戴设备与互补传感器(心率、血氧饱和度)结合使用,以丰富解释;专家组认可在认知未受损的老年人中使用家庭血氧饱和度筛查OSA。
3) 需要测量的具体睡眠和昼夜特征(共识中的方框1)
核心客观特征(动态记录仪和/或PSG/EEG):
– 睡眠片段化指数(觉醒次数、唤醒、阶段转换)。
– 睡眠效率和入睡后清醒时间(WASO)。
– 总睡眠时间和睡眠持续时间。
– 在睡眠阶段(N1, N2, N3, REM)中花费的时间和阶段百分比。
– NREM频谱功率和慢波特征(包括慢波活动幅度和形态)。
– REM频谱功率和REM相关的EEG减速。
– 白天活动指标、时间、变异性和白天休息/小睡事件。
核心临床/自报特征:
– 一般睡眠障碍和睡眠质量差。
– 失眠症状(入睡困难/维持睡眠困难、非恢复性睡眠)。
– 日间过度嗜睡(例如,Epworth嗜睡量表)。
4) 动态记录仪的具体内容:持续时间和日记使用
– 最少:7连续天;理想:≥14天以获得稳健的昼夜和变异性测量。
– 总是将简单的睡眠日记与动态记录仪结合使用,以探测潜伏期、时间、小睡、咖啡因/酒精/药物使用、早晨清醒感和夜间干扰。
– 明确报告用于睡眠/清醒评分的算法,从日记数据中做出的任何调整,以及时间段长度。
5) 多导睡眠图的具体内容
– 对于旨在检查睡眠微观结构(慢波、纺锤波)、唤醒指数、OSA严重程度和其他生理信号的研究,优先使用PSG/EEG。
– 对于多中心或队列研究,围绕推荐的核心站点协调电极排列,并尽可能共享处理管道。
6) 药物和暴露报告
– 记录精神药物和睡眠药物的暴露情况,专家组在设计临床试验时倾向于使用一个月的回顾窗口来记录药物使用;较短的窗口(2周至1周)也是允许的,但较少受到青睐。
7) 数据共享和协调
– 专家组强烈建议建立一个全球联盟,以共享和协调睡眠和痴呆数据(以标准化变量、处理管道,并启用跨队列的汇总分析)。
专家评论和见解
专家组观点
– 专家组强调了务实的平衡:优先使用客观测量方法(PSG/EEG和动态记录仪),但也认识到可行性限制——家庭监测、较长的动态记录仪持续时间和经过验证的可穿戴设备是扩大研究规模的实用方法。
– 专家组反复强调需要在老年人和认知受损群体中验证设备和算法,而不是从年轻健康人群外推性能。
– 强烈共识认为,单晚快照(一夜PSG或短期动态记录仪)不足以回答许多研究问题;多夜和连续监测更好地捕捉变异性及昼夜特征。
争议和未达成共识的领域
– 专家组并未普遍支持用可穿戴EEG设备完全替代完整的PSG;对研究级EEG可穿戴设备的信心不一,对消费级EEG设备的信心较低。进一步的验证研究仍然是必要的。
– 实验室PSG与家庭PSG的相对角色取决于研究问题和参与者群体:没有在所有情况下都偏好的统一偏好。
研究建议的临床意义
– 尽管这些建议针对研究,但它们对临床试验和最终临床实践有直接的影响。标准化评估将使睡眠干预的清晰试验成为可能,并明确确定睡眠修改是否可以预防或减缓AD。
– 临床医生应谨慎解释老年人消费者的睡眠指标,并在睡眠评估将影响治疗决策时优先使用经过验证的工具。
实际意义
对于计划新研究的研究团队
– 在研究CRF中包含共识核心数据集;在出版物中报告这些变量以促进汇总。
– 优先使用经过验证的动态记录仪,目标≥7天的记录;如果可能,目标≥14天。
– 与动态记录仪一起使用睡眠日记;在方法中披露算法和评分规则。
– 如果使用消费者设备,进行针对PSG/动态记录仪的验证子研究,或将研究级传感器用于主要终点。
对于资助者和联盟建设者
– 支持包括睡眠和昼夜测量的纵向、多中心队列。
– 资助在老年人和认知受损人群中验证可穿戴设备的研究。
– 支持测试治疗OSA、失眠或昼夜失调是否改变认知衰退或AD生物标志物的临床试验。
患者案例(说明性)
– 玛丽·约翰逊,66岁,有主观记忆投诉和睡眠片段化。遵循共识的研究团队会:对她进行临床特征描述(认知测试、教育、BMI、共病),获取14天的手腕动态记录仪加睡眠日记以评估片段化和小睡,如果微结构是重点,则进行家庭EEG/PSG,记录OSA的药物/状态,并且如果参与试验,测量AD生物标志物和APOE状态作为核心加数据。
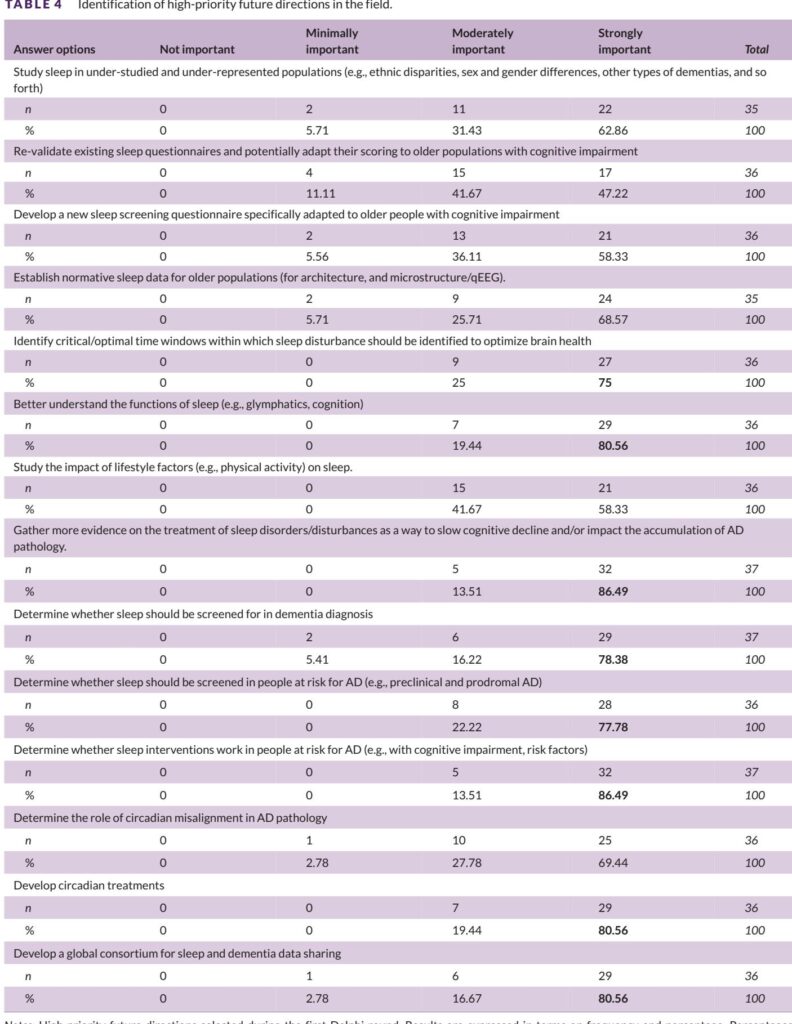
高优先级研究议程(方框合成)
共识中的前五大研究优先事项:
1. 具有重复睡眠和昼夜测量的纵向队列研究,以定义轨迹和时间顺序。
2. 随机临床试验,测试睡眠和昼夜干预(OSA治疗、失眠治疗、昼夜同步)是否影响认知和AD生物标志物。
3. 动态记录仪方法的协调和共享处理管道的开发。
4. 特别是在老年人和MCI/AD痴呆人群中验证可穿戴和近身设备的研究。
5. 研究未充分研究的人群,包括性别分层样本、有轮班工作史的人群、种族/族裔少数群体、非AD痴呆症患者和中年人(40–65岁)。
参考文献
1. André C, Stankeviciute L, Michaelian JC, et al.; Sleep and Circadian Rhythms Professional Interest Area of ISTAART. International recommendations for sleep and circadian research in aging and Alzheimer’s disease: A Delphi consensus study. Alzheimers Dement. 2025 Oct;21(10):e70742. doi:10.1002/alz.70742.
2. Livingston G, Huntley J, Liu KY, et al. Dementia prevention, intervention, and care: 2024 report of the Lancet standing Commission. Lancet. 2024;404(10452):572–628. doi:10.1016/S0140-6736(24)01296-0.
3. Ju YE, Lucey BP, Holtzman DM. Sleep and Alzheimer disease pathology–a bidirectional relationship. Nat Rev Neurol. 2014;10(2):115–119. doi:10.1038/nrneurol.2013.269.
4. Bubu OM, Brannick M, Mortimer J, et al. Sleep, cognitive impairment, and Alzheimer’s disease: a systematic review and meta-analysis. Sleep. 2017;40(1):zsw032. doi:10.1093/sleep/zsw032.
5. Mander BA. Local sleep and Alzheimer’s disease pathophysiology. Front Neurosci. 2020;14:525970. doi:10.3389/fnins.2020.525970.
6. de Zambotti M, Goldstein C, Cook J, et al. State of the science and recommendations for using wearable technology in sleep and circadian research. Sleep. 2024;47(4):zsad325. doi:10.1093/sleep/zsad325.
7. De Zambotti M, Cellini N, Goldstone A, Colrain IM, Baker FC. Wearable sleep technology in clinical and research settings. Med Sci Sports Exerc. 2019;51(7):1538–1557. doi:10.1249/MSS.0000000000001947.
8. Ong JL, Golkashani HA, Ghorbani S, et al. Selecting a sleep tracker from EEG-based, iteratively improved, low-cost multisensor, and actigraphy-only devices. Sleep Health. 2024;10(1):9–23. doi:10.1016/j.sleh.2023.11.005.
9. Buysse DJ, Reynolds CF 3rd, Monk TH, Berman SR, Kupfer DJ. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Res. 1989;28(2):193–213. doi:10.1016/0165-1781(89)90047-4.
10. Lee T, Cho Y, Cha KS, et al. Accuracy of 11 wearable, nearable, and airable consumer sleep trackers: prospective multicenter validation study. JMIR Mhealth Uhealth. 2023;11:e50983. doi:10.2196/50983.
注:上述参考文献包括主要的德尔菲共识(André等人)以及关于睡眠、痴呆症和可穿戴设备验证的基础和最新文献。共识声明旨在提供研究指导,不会取代未来的临床实践指南;德尔菲研究的作者表示,临床建议将在单独的出版物中发布。