亮点
– 在一项II期多中心研究中,新型选择性JAK2抑制剂OB756在对羟基脲或干扰素不耐受/抵抗的原发性血小板增多症(ET)患者中诱导了快速的血小板和白细胞减少以及症状改善。
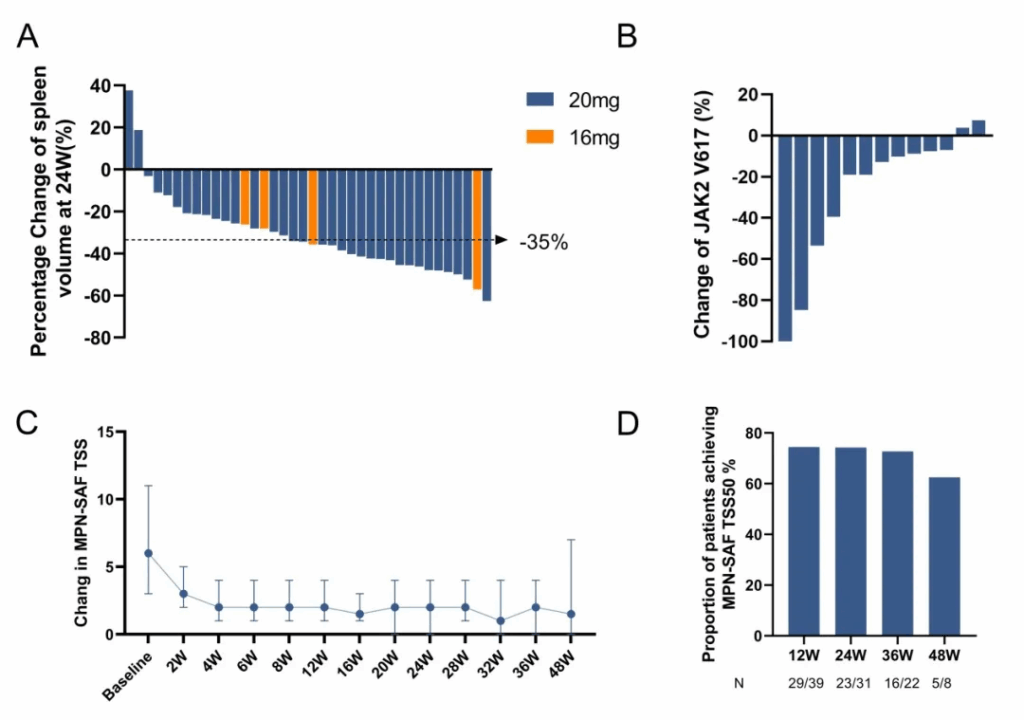
– 在第24周时,意向治疗完全血液学反应(CHR)率为22%;血液学反应(HR)率随时间增加,第24周为65.6%,第48周时可达90%。
– 大多数可评估患者的脾脏体积减少(中位数-34.96%),多数可评估患者的JAK2 V617F等位基因负担下降;不良事件通常为1-2级,贫血和感染是最常见的毒性反应。
背景与临床需求
原发性血小板增多症(ET)是一种慢性费城染色体阴性的骨髓增生性肿瘤,其特征是持续性血小板增多、血栓出血风险及由血管运动现象、疲劳和部分患者脾肿大引起的症状负担。高危ET的标准细胞减少疗法通常包括羟基脲(HU)或干扰素α(IFN)。然而,有一部分患者对这些药物不耐受或抵抗,需要替代策略。激活JAK-STAT通路的突变,尤其是JAK2 V617F突变,是ET病理生理学的核心,为JAK靶向治疗提供了理论依据。
JAK1/2抑制剂鲁索利替尼已在对HU不耐受或抵抗的ET患者中进行了评估,疗效不一,且安全性特征包括细胞减少和感染。目前仍需开发耐受性良好、有效的选择性针对JAK2驱动疾病生物学的药物,以减轻症状负担和脾脏体积,并理想地降低突变等位基因负担而不产生过多的脱靶毒性。
研究设计
黄等报告的试验是一项II期、开放标签、多中心研究,在中国的12个中心进行,招募了≥18岁的ET成人患者,这些患者对羟基脲不耐受或抵抗,或对干扰素不耐受。符合条件的患者ECOG体能状态≤2,接受口服OB756治疗,每日两次,剂量为16 mg(探索性亚组,n=5)或20 mg(n=45),每28天一个周期,直至疾病进展或不耐受。
预设的主要终点是在第24周时的完全血液学反应(CHR),定义为血小板计数≤400×10^9/L,白细胞(WBC)计数<10×10^9/L,无疾病相关症状,影像学检查脾脏大小恢复正常。次要终点包括随时间变化的血液学反应(HR)率、安全性和耐受性、分子反应(JAK2 V617F等位基因负担的变化)、第24周时脾脏体积减少≥35%(SVR35)以及通过MPN-SAF TSS(骨髓增生性肿瘤症状评估表总症状评分)测量的症状控制。
患者群体和基线特征
2020年11月至2024年5月期间,共筛选了96名患者,其中50名被纳入并接受了治疗。中位年龄为59岁(范围18-81岁),42%为男性,从ET诊断到入组的中位时间为866天。既往治疗的不耐受或抵抗包括羟基脲不耐受(44%)、羟基脲抵抗(28%)和干扰素不耐受(28%)。该队列在分子上具有典型的ET特征:70%为JAK2 V617F阳性,20%为CALR突变,2%为MPL突变。基线中位血小板计数较高,为780×10^9/L(范围298-1929),WBC为6.9×10^9/L,血红蛋白为139 g/L。
关键疗效结果
OB756在不影响血红蛋白的情况下迅速降低了血小板和白细胞计数。在每日两次20 mg的组别中,中位血小板计数从基线的778×10^9/L降至4周内的最低点512×10^9/L;每日两次16 mg的探索性组别在第6周时显示较慢的减少。WBC在两周内从中位数6.9×10^9/L降至5.7×10^9/L。血红蛋白在整个治疗过程中保持稳定。
根据意向治疗(ITT)分析,第24周的CHR为22%(11/50)。在特定时间点评估的可评估患者中,CHR率分别为第12周21.7%(10/46)和第24周23.7%(9/38)。可评估患者的HR率随时间增加:第12周为56.6%(26/46),第24周为65.6%(25/38),第36周为76%(19/25),第48周为90%(9/10)。
在有可评估影像学检查的患者亚组中,脾脏反应显著:第24周时,94.7%(36/38)的患者脾脏体积有所减少,中位减少-34.96%(范围-63%至+38%),50%(19/38)的患者达到SVR35(≥35%减少)。
在13名有基线JAK2 V617F检测结果的可评估患者中,84.6%(11/13)的患者在治疗后等位基因负担减少;61.5%(8/13)的患者减少≥10%。症状负担一致改善:在43名基线MPN-SAF TSS >0的患者中,第12周时TSS50(≥50%减少)的比例为74.4%,第24周时为74.2%,在后续时间点的患者数量减少时仍可见持续的益处。
安全性和耐受性
总体而言,治疗出现的不良事件(TEAEs)主要为1-2级。血液学毒性包括52%(26/50)的患者出现贫血,其中10%(5/50)为≥3级贫血;6%(3/50)的患者出现中性粒细胞减少。非血液学≥3级不良事件最常见的是感染,发生在16%(8/50)的患者中,另有14名患者出现1-2级感染。两名患者(4%)发生血栓事件(共四次事件),均为腔隙性脑梗死;研究者认为这些事件与研究药物无关。研究期间未记录到白血病转化或进展为明显骨髓纤维化的病例。有一例院外死亡被裁定与OB756无关。
总之,报告的安全性特征表明,毒性谱可控,主要表现为轻度的细胞减少和感染事件;不良事件被描述为临床上可管理的。
解释与临床意义
数据表明,OB756在因对HU或IFN不耐受或抵抗而选择有限的ET患者群体中实现了生物学和临床意义上的效果。快速的血小板和WBC控制、客观的脾脏体积减少、症状改善(MPN-SAF TSS)以及可测量的JAK2 V617F等位基因负担减少支持了JAK2抑制的靶向作用和疾病修饰潜力。
重要的是,第24周时ITT分析的CHR率(22%)看似较低,但可评估患者的HR率随时间增加,后期时间点的反应率更高。这种模式表明,一些患者在未达到严格的CHR标准或继续治疗后达到了临床上有意义的控制。相对较小的样本量、开放标签设计以及不同时间点可评估患者的分母变化使得直接解释复杂化,需要谨慎与现有药物进行比较。
大多数可评估患者中JAK2等位基因负担的有利影响令人鼓舞,尽管分子样本量较小(n=13),且减少幅度一般。这些分子变化是否转化为长期的血栓风险降低、疾病进展或克隆进化减少,需要更长时间的随访和更大规模的对照试验。
优势与局限性
本研究的优势包括多中心设计、招募了对一线治疗不耐受或抵抗的真实世界ET患者群体、全面的血液学、症状、脾脏和分子终点,以及合理的治疗暴露时间(中位数约11个月,部分患者治疗超过3年)。
局限性包括单臂、开放标签的II期设计没有随机对照组;整体样本量较小,某些次要终点的可评估亚组更小(特别是分子反应);评估长期结局(如血栓、转化为AML或进展为骨髓纤维化)的随访时间有限;提供的总结中缺少集中裁定的血栓评估或盲法放射学审查。安全信号——尤其是感染和贫血——需要在更大的队列中进行持续监测。
下一步和研究重点
推进OB756进入临床使用的关键步骤应包括随机III期试验,将OB756与当前最佳替代方案在对HU/IFN不耐受或抵抗的ET患者中进行比较,标准化血栓监测和裁定,更大的分子队列以表征等位基因负担反应的深度和持久性,以及更长时间的随访以评估对疾病进展、白血病转化和生存的影响。可以考虑剂量优化和在其他JAK2驱动的骨髓增生性肿瘤中的探索,以及转化研究以了解该药物的选择性谱和与JAK1/2抑制剂相比的免疫学效应。
结论
在这项II期多中心研究中,OB756在对羟基脲或干扰素不耐受或抵抗的ET患者中展示了具有临床意义的血小板和白细胞控制、症状缓解、脾脏体积减少以及JAK2 V617F等位基因负担减少。其安全性可控,主要为低级别不良事件,尽管感染和贫血较为显著。这些结果支持OB756的进一步开发,并证明了随机试验的必要性,以确定其相对疗效、长期安全性和对血栓风险及疾病进展的影响。
资金来源和试验注册
资金来源和临床试验注册号未在可用的总结中提供。
参考文献
Huang J, Li R, Gong T, Guo P, Shou L, Zhou H, Jiao Z, Zhang F, Liu Q, Zhao L, Wu G, Chen L, Zhou Y, Zhang Y, Jin J. Efficacy and safety of OB756 (a novel selective JAK2 inhibitor) for essential thrombocythemia in patients intolerant of or resistant to hydroxyurea or intolerant of interferon: A phase 2, open-label, multicenter study. Cancer. 2025 Oct 15;131(20):e70101. doi: 10.1002/cncr.70101
IF: 5.1 Q1 B1 . PMID: 41060136
IF: 5.1 Q1 B1 .