引言
尽管手术、化疗和放疗等传统疗法取得了进展,但癌症仍然是全球主要的健康挑战,每年新增数百万病例和死亡。免疫治疗作为一种有前景的治疗模式,尤其是对实体瘤。然而,其临床成功常常受到系统性毒性和抑制性肿瘤微环境(TME)的限制,这些因素阻碍了免疫细胞的浸润和功能。
纳米技术的出现为癌症治疗开辟了新的途径,实现了靶向药物递送和TME的调节。在各种材料中,锰(Mn)作为一种必需的微量元素,因其独特的生物和免疫调节特性而受到关注。最近的证据表明,锰纳米颗粒(Mn-NPs)在增强免疫反应、促进免疫原性细胞死亡(ICD)以及提高免疫检查点抑制剂(ICIs)和光疗的疗效方面发挥了重要作用。本文全面概述了锰和Mn-NPs如何推进癌症免疫治疗的机制,阐述了它们与现有治疗策略的整合,并讨论了临床转化中的挑战和未来前景。
锰及其纳米颗粒的生物学作用
锰对于多种生理过程至关重要,包括超氧化物歧化酶和精氨酸酶的酶活性。细胞内Mn主要以$plus2$离子形式存在于高尔基体和线粒体等细胞器中。关键转运蛋白如DMT1促进Mn的细胞摄取。Mn表现出多样的氧化态,这是其催化多功能性的基础。
特别是二氧化锰($MnO2$)的锰氧化物纳米颗粒表现出氧化还原活性,可以利用TME的酸性和还原特性。这些纳米颗粒催化谷胱甘肽(GSH)和过氧化氢($H2O2$)的耗竭,缓解缺氧并生成诱导肿瘤细胞氧化应激的活性氧(ROS)。这种催化活性导致自由Mn离子的释放,进一步参与细胞内免疫途径。
锰对免疫反应的调节
Mn介导的免疫激活的一个关键机制涉及cGAS/STING途径。细胞质双链DNA(dsDNA)在癌细胞损伤过程中释放,激活DNA传感器cGAS,最终导致STING介导的I型干扰素产生。Mn增强cGAS的酶活性并加强STING/cGAMP的结合亲和力,促进树突状细胞(DC)成熟和细胞毒性T淋巴细胞(CTL)活化。体内实验表明,补充Mn可增加活化的CD8+ T细胞和自然杀伤(NK)细胞的肿瘤浸润,显著增强抗肿瘤免疫。
此外,Mn-NPs通过分解肿瘤过度表达的$H2O2$成氧气来调节免疫抑制的TME,减轻缺氧并使肿瘤相关巨噬细胞极化为促炎性M1表型。GSH的耗竭减少了肿瘤细胞的抗氧化防御,增强了氧化损伤。Mn通过线粒体效应进一步增加ROS的产生,最终导致ICD和损伤相关分子模式(DAMPs)的释放,促进先天性和适应性免疫反应。
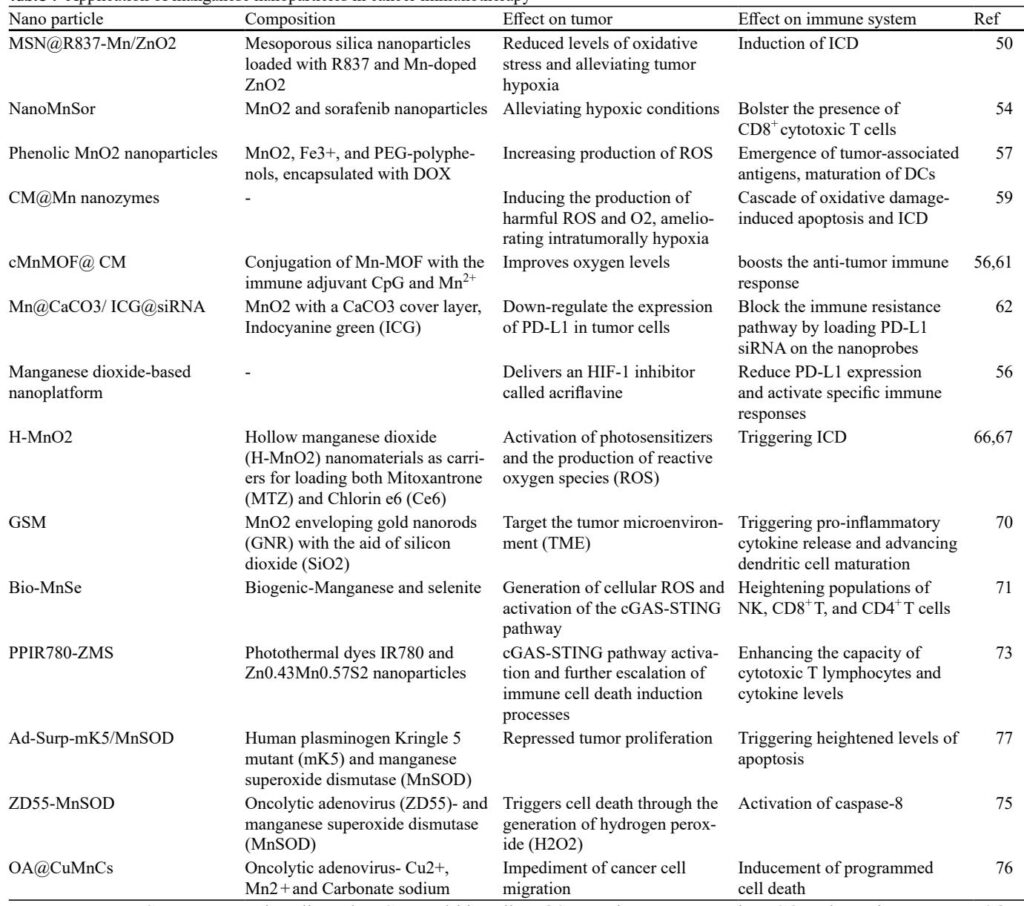
锰在联合免疫治疗中的应用
Mn和Mn-NPs在多方面的癌症免疫治疗平台中作为有效的佐剂和载体:
1. 肿瘤靶向单克隆抗体(mAbs): 负载Mn的纳米颗粒与肿瘤特异性mAbs偶联,实现选择性递送和成像,增强抗体依赖性细胞毒性和吞噬作用。这些平台改善了治疗靶向性,特别是在表达HER2/neu和EGFR等受体的异质性肿瘤中。
2. 免疫检查点抑制剂(ICIs): Mn-NPs与ICIs协同作用,将免疫学上“冷”的肿瘤转变为“热”肿瘤,增加抗原呈递和CTL浸润。Mn介导的肿瘤缺氧和氧化应激的缓解进一步使肿瘤对PD-1/PD-L1阻断敏感,提高响应率。
3. 免疫原性细胞死亡(ICD)诱导剂: Mn-NP平台通过控制药物释放、ROS生成和氧气供应来增强ICD诱导,增强肿瘤抗原的释放和DC的成熟。将Mn与光动力和光热疗法结合的组合策略已显示出强大的抗肿瘤免疫激活。
4. 溶瘤病毒(OVs): 工程化OVs表达Mn超氧化物歧化酶(MnSOD)或与基于Mn的纳米材料结合,通过增加肿瘤细胞内的氧化应激和增强免疫浸润来放大溶瘤活性,有望克服OV耐药性和增强全身抗肿瘤免疫。
锰作为疫苗佐剂
Mn离子通过cGAS-STING和炎症小体途径增强先天免疫感知,促进有效的抗原呈递和T细胞启动。基于Mn的纳米载体在纳米疫苗设计中增强体液和细胞反应,促进生发中心的形成和促炎性细胞因子的分泌。结合Mn和免疫刺激分子的混合佐剂显示了双重激活免疫途径的机会,为更安全和更有效的癌症疫苗提供了机会。
用于药物递送和成像的先进Mn基纳米颗粒
基于锰的磁性纳米颗粒具有多功能性,既可用作药物载体,也可用作磁共振成像(MRI)造影剂。负载Mn的铁氧体表现出优异的T2对比度,并且可以通过功能化靶向配体来增强肿瘤积累。空心MnO2纳米颗粒在酸性肿瘤环境中实现刺激响应性药物释放。尽管前景广阔,但Mn-NPs的临床转化需要彻底评估生物安全性、长期生物分布、潜在神经毒性和标准化合成方法。
挑战和缓解策略
Mn-NPs在临床上的应用面临潜在毒性累积、类似帕金森综合征的神经毒性效应和免疫相关不良事件(irAEs)等挑战。这些挑战凸显了精确剂量、靶向递送系统和全面的长期临床前安全性评估的必要性。表面修饰使用聚乙二醇(PEG)、人血清白蛋白(HSA)或透明质酸(HA)等生物相容性涂层可以提高稳定性和生物相容性。建立标准化、环保的纳米颗粒合成方法至关重要。
结论和未来展望
锰及其纳米尺度衍生物预示着癌症免疫治疗的新前沿,作为免疫调节剂、佐剂和药物递送载体,独特地应对肿瘤微环境带来的挑战。它们激活关键免疫途径、增强ICD和提高现有疗法的能力,使其成为下一代肿瘤治疗方案的重要组成部分。
未来研究应集中在阐明Mn介导的免疫调节的详细机制、优化纳米颗粒设计以实现靶向递送和最小毒性,并推进临床试验以验证安全性和有效性。由基于锰的材料引入的“金属免疫治疗”概念有望革新癌症治疗,可能改善对耐药或复发恶性肿瘤患者的治疗结果。
参考文献
Moosavi Zenooz A, Eterafi M, Azarmi Giglou S, Safarzadeh E. Embracing cancer immunotherapy with manganese particles. Cell Oncol (Dordr). 2025 Aug;48(4):899-920. doi: 10.1007/s13402-025-01070-9. Epub 2025 May 21. PMID: 40397376; PMCID: PMC12238167.