亮点
– 在ESMO 2025上报告的一项多中心I/II期研究中,口服KRAS G12D选择性抑制剂GFH375在既往治疗的KRAS G12D突变胰腺导管腺癌(PDAC)患者中,经研究者评估的客观缓解率(ORR)为40.7%,疾病控制率(DCR)为96.7%。
– 中位无进展生存期(PFS)为5.52个月(90% CI 4.27–7.20);中位总生存期(OS)尚未达到,中位随访时间为5.65个月;安全性特征可管理,≥3级治疗相关不良事件(TEAEs)发生率为31.8%,未报告治疗相关死亡。
背景与未满足需求
胰腺导管腺癌
( PDAC ) 之所以被称作「癌症之王」,绝非浪得虚名——美国癌症协会最新发布数据[1] 50 年前相比,胰腺癌患者的 5 年生存率已从 3% 提升至 13% ,仍在所有常见瘤种中「垫底」。根据中国医学科学院国家癌症中心的统计数据[2] 2024 年中国胰腺癌新增病例数 76030 例,死亡例数 68222 例。
KRAS致癌基因突变是PDAC的主要分子驱动因素;超过90%的肿瘤携带KRAS突变,其中KRAS G12D是一个常见亚型。历史上,由于其生化特性和缺乏可及的结合口袋,KRAS被认为是一个难以靶向的药物目标。最近在药物设计和结构导向方法方面的进展产生了选择性的KRAS抑制剂,首先是G12C,现在是针对其他热点突变如G12D的药物。在KRAS G12D突变PDAC中展示出有意义的临床活性将代表这一高需求人群的重大治疗进展。
超过80%患者确诊时已属晚期,错失手术机会,这使得药物治疗成为其主要治疗手段。可现实是,晚期胰腺癌的药物选择十分有限,亟需更多更好的治疗方案。
2025 年欧洲肿瘤内科学会 ( ESMO ) 大会上,一项以最新突破摘要 ( LBA84 ) 形式公布的研究 [3] ,终于给这片「绝望之地」带来曙光!口服 KRAS G12D 抑制剂 GFH375 ,单药治疗经多线治疗的 KRAS G12D 突变晚期 PDAC 患者,客观缓解率 ( ORR ) 达 40.7% ,疾病控制率 ( DCR ) 飙至 96.7% ,带来实实在在「活下去」的新希望!
PDAC 的难治,除了进展快、症状隐匿,更核心的问题在于治疗缺乏「趁手武器」。长期以来,晚期 PDAC 的治疗主要依赖于化疗,可耐药性往往来得又快又猛,往往几个周期后病情就会进展。
而在 PDAC 的分子驱动因素中, KRAS 突变是最关键的「突破口」之一——超过 90% 的 PDAC 患者存在 KRAS 突变,其中 KRAS G12D 是最常见的亚型,占比高达 40% [4] ,作为 PDAC 的治疗靶点可以说是非常理想的。
可过去近 40 年, KRAS 一直是肿瘤新药研发中的「硬骨头」——它的蛋白体积小、表面光滑,没有小分子药物能稳定结合的「口袋」,药物开发难度极大。直到近年「共价抑制」「非共价结合 」等新策略出现, KRAS 靶向治疗才终于迎来转机。
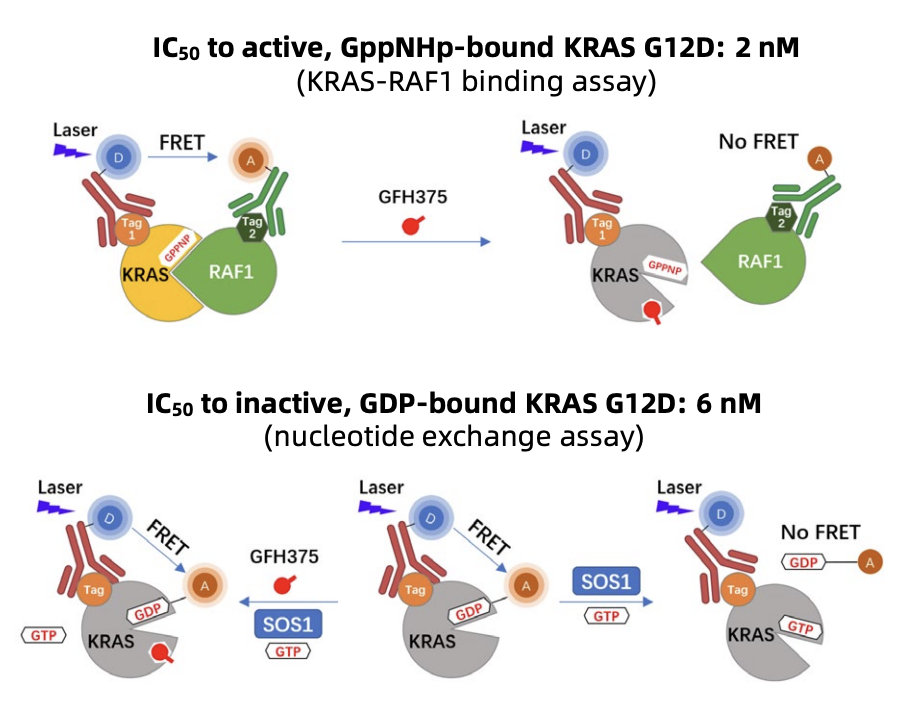
而本次研究的主角GFH375,正是一款口服、强效、高选择性的KRASG12D抑制剂,最特别的是,它能通过非共价结合方式,同时「锁住」KRASG12D的两种状态——GDP结合的失活态和GTP结合的激活态,彻底阻断其下游信号通路,从而精准「掐断」肿瘤细胞的增殖信号。临床前研究显示,GFH375的抗肿瘤活性会随治疗剂量和周期增加而增强,且脱靶风险低,亦为后续临床应用打下了安全基础。
GFH375 的分子机制
GFH375后线「单挑癌王」:超九成患者肿瘤缩小!
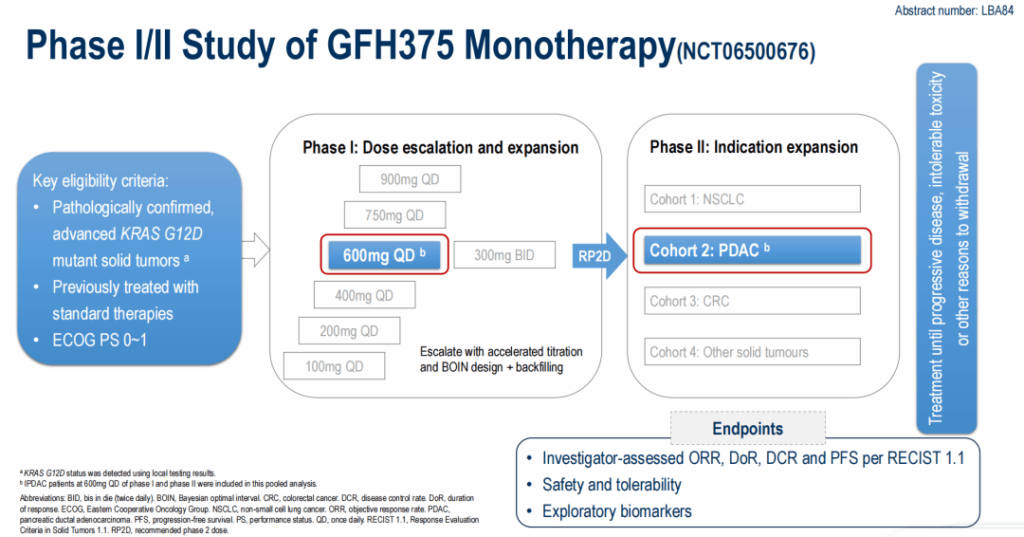
这项在 ESMO 中备受关注的全球多中心 I/ Ⅱ期临床研究 ( NCT06500676 ) ,其 I 期部分包括剂量递增 ( 100mgQD 至 900mgQD 及 300mgBID ) 和扩展阶段;Ⅱ期为适应证扩展阶段,包括非小细胞肺癌 ( NSCLC ) 、 PDAC 、结直肠癌 ( CRC ) 及其他实体瘤队列。本次公布的是接受 600mgQD (Ⅱ期推荐剂量, RP2D ) GFH375 单药治疗的 PDAC 患者数据。研究终点包括研究者评估的客观缓解率 ( OR R ) 、缓解持续时间 ( DOR ) 、疾病控制率 ( DCR ) 、 PFS (依据 RECIST1.1 标准) 、安全性、耐受性及探索性生物标志物。
研究设计
截至 2025 年 9 月 27 日,共 66 例晚期 KRASG12D 突变 PDAC 患者接受了治疗。其中 95.5% 的患者在入组时为Ⅳ期,最常见的基线转移部位包括肝脏 ( 78.8% ) 、肺 ( 28.8% ) 和腹膜 ( 28.8% ) 。 68.2% 的患者既往接受过≥ 2 线抗肿瘤治疗, 33.3% 的患者既往接受过免疫检查点抑制剂 ( ICIs ) 治疗。数据截止时,仍有 31 例 ( 47.0% ) 患者在接受治疗。
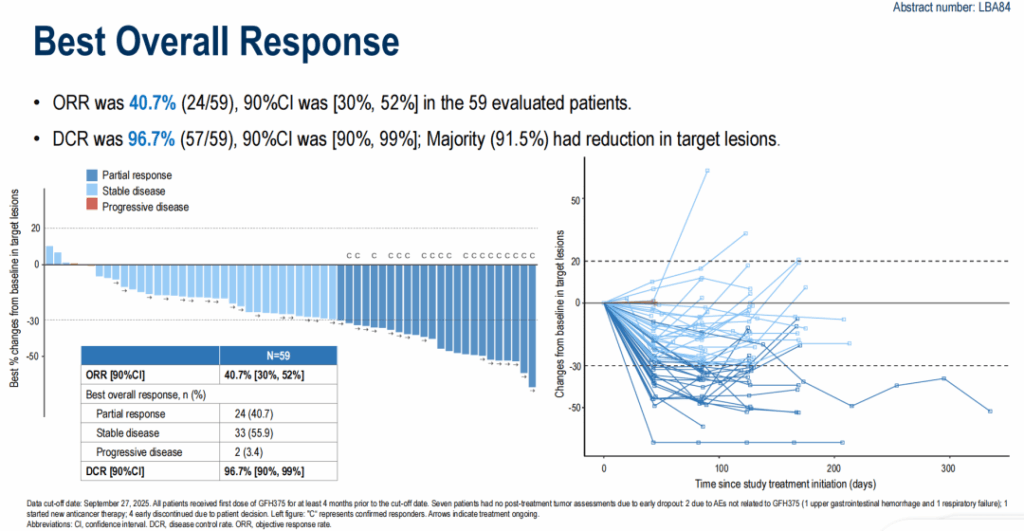
在 59 例可评估疗效的患者中,经研究者评估的 ORR 为 40.7% 。其中 24 例 ( 40.7% ) 为部分缓解 ( PR ) , 33 例 ( 55.9% ) 为疾病稳定 ( S D ) ,仅 2 例 ( 3.4% ) 出现疾病进展 ( PD ) 。 DCR 高达 96.7% , 91.5% 的患者靶病灶较基线缩小。 GFH375 单药治疗显示出确切的抗肿瘤效果,几乎所有患者都能从治疗中获益!
肿瘤缓解情况
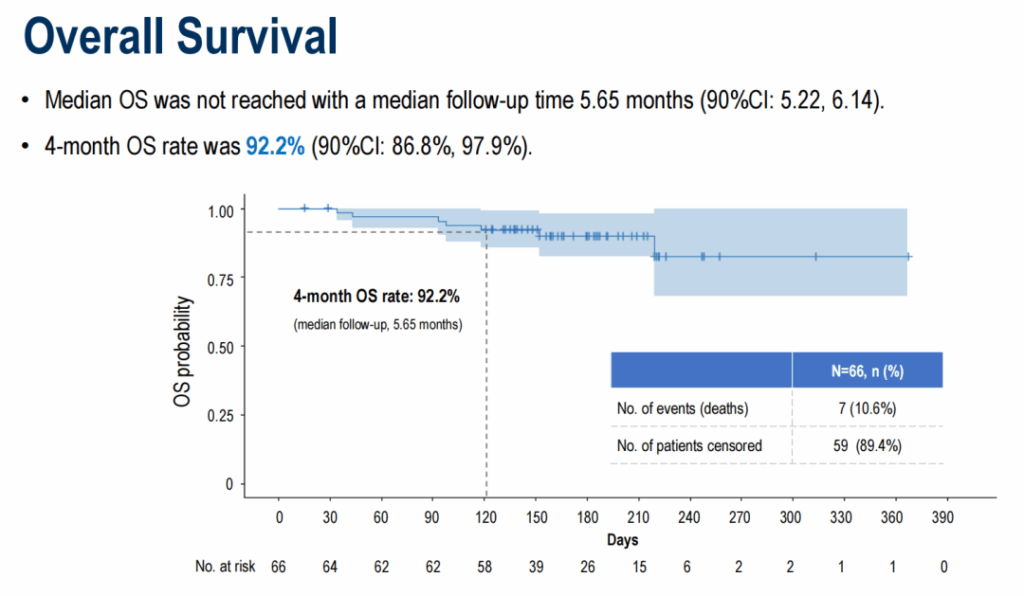
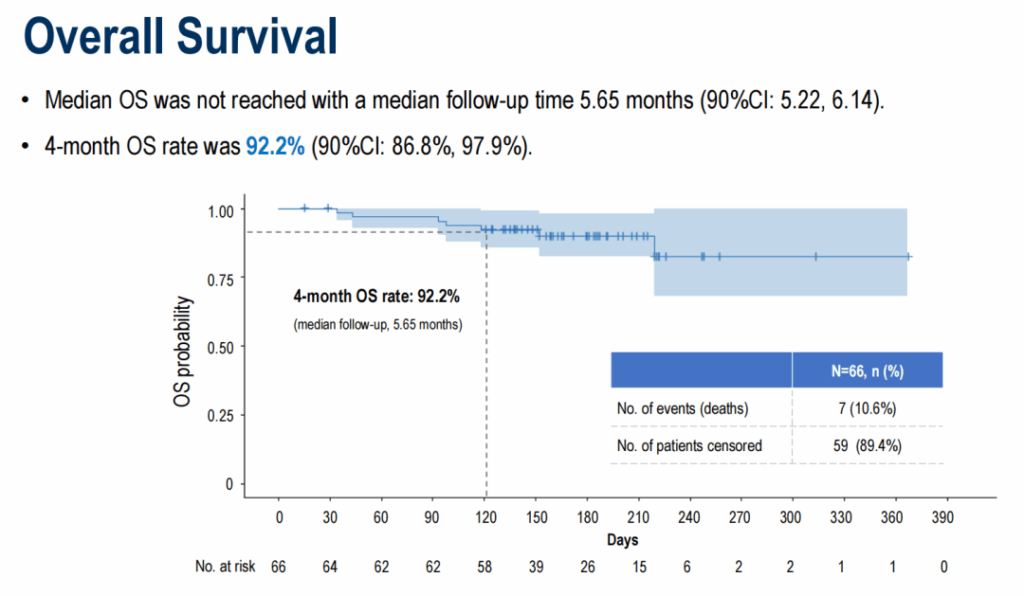
中位随访 5.65 个月时,中位 PFS 为 5.52 个月 ( 90%CI 4.27-7.20 个月) , 4 个月 PFS 率为 78.2% ( 90%CI 69.8%-87.5% ) 。中位 OS 尚未达到, 4 个月 OS 率达到 92.2% ( 90%CI 86.8%-97.9% ) 。
PFS 数据
OS 数据
GFH375 在 II 期临床研究中针对 KRASG12D 突变的 PDAC 患者显示出良好的安全性和耐受性,与既往报道一致。常见的治疗相关不良事件 ( TRAE ) 主要为胃肠道和血液学不良事件 ( AE ) ,大多数为 1-2 级,且可通过支持性治疗进行管理。所有患者 ( 100% ) 均经历了至少一次治疗期间出现的不良事件 ( TEAE ) 和 TRAE 。≥ 3 级 TEAE/TRAE 的发生率为 31.8% ( 21 例) ,未出现致命性 TRAE 。
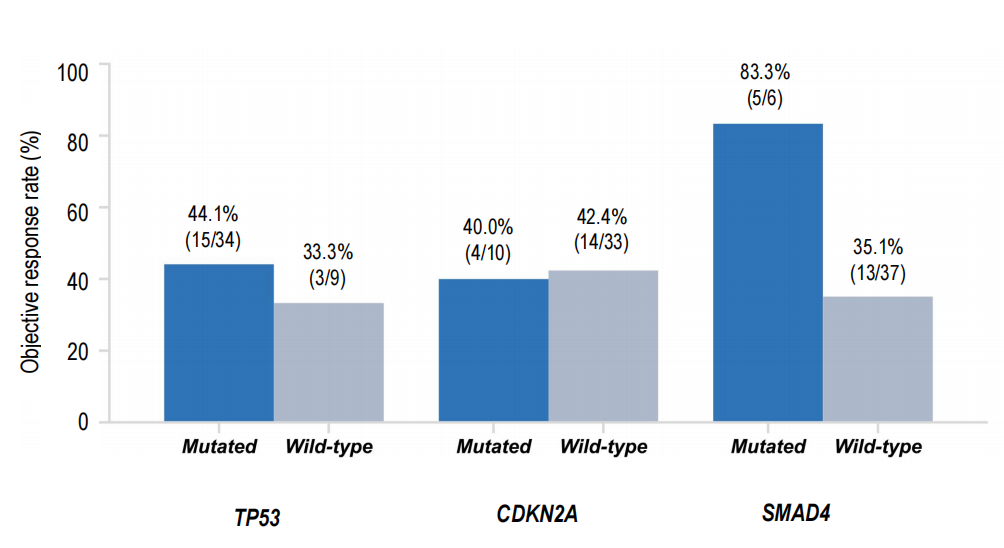
本次分析还有一个「意外」发现:即使患者合并SMAD4 、TP53等PDAC中常见的「不良预后基因突变」,仍能从GFH375中获益。特别是SMAD4共突变患者,ORR高达83.3%,比SMAD4野生型患者(35.1%)还高,表明GFH375的疗效不受这些「坏基因」的限制,适用人群更广。
基线 ctDNA 分析
共突变基因与肿瘤缓解
研究表明, GFH375 单药治疗在经多线治疗的 KRASG12D 突变晚期 PDAC 患者中,既能带来显著的抗肿瘤疗效,安全性可控,强烈支持继续推进后续的临床开发。而在日前 ( 11 月 11 日) , 一项比较 G F H375 和化疗治疗 KRASG12D 突变型转移性胰腺癌患者的Ⅲ期研究已在药物临床试验登记与信息公示平台官网登记公示,让我们拭目以待! 回顾 KRAS 靶点的研发史,从「不可成药」的标签,到如今 GFH375 等抑制剂陆续取得突破,背后是无数科研人员的坚持与创新。对晚期 PDAC 患者来说, GFH375 带来的不仅是更长的生存时间,也是「癌症之王并非不可战胜」的信心。期待Ⅲ期研究能早日传来捷报,也盼着 GFH375 能尽快落地临床,让更多 KRAS G12D 突变的晚期胰腺导管腺癌患者都能及时用上这款好药,重获治疗的勇气与生存的希望。
下一步和持续开发
基于这些数据,一项比较GFH375与化疗的随机III期试验已在2025年11月11日注册并公开披露。III期设计、终点和纳入标准将决定I/II期中观察到的信号是否转化为可重复的生存获益,并成为这一分子定义亚群的新标准治疗。
专家评论
GFH375代表了胰腺癌精准肿瘤学的重要进展。长期以来,KRAS被称为“不可成药”,而G12C抑制剂的成功证明了KRAS靶向治疗的可行性。G12D是一个不同的生化挑战,在PDAC中更为普遍;因此,GFH375的临床活性特别值得注意。
临床医生应保持谨慎乐观。如果III期结果确认这些发现,KRAS G12D检测将成为PDAC管理中的必要步骤,GFH375可能为已进展的标准化疗患者提供一种生物学合理、靶向的口服治疗选项。同时,应优先进行全面的生物标志物研究、耐药机制映射和联合策略(例如与化疗、间质修饰剂或免疫疗法联用),以最大化获益并克服获得性耐药。
结论
ESMO 2025对GFH375的报告提供了令人鼓舞的证据,表明选择性、口服可用的KRAS G12D抑制可以在重度预处理的PDAC人群中产生显著的肿瘤反应和疾病控制,且安全性可管理。这些结果支持在随机研究中继续开发,并强调了在PDAC中常规进行分子谱型分析的重要性,以识别可能受益于新兴靶向治疗的患者。
资助与试验注册
这里讨论的I/II期研究注册号为NCT06500676。一项比较GFH375与化疗的随机III期研究已在2025年11月11日注册并公开发布。ESMO摘要中未详细说明资金来源;研究者报告了来自研究赞助商的支持。完整的披露信息将在随后的同行评审出版物和监管文件中提供。
参考文献
1. Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024. CA Cancer J Clin. 2024;74(1):12-49.
2. Wu Y, He S, Cao M, et al. Comparative analysis of cancer statistics in China and the United States in 2024. Chin Med J (Engl). 2024;137(24):3093-3100.
3. Zhou A, Li Z, Sun Y, et al. Efficacy and safety of GFH375 monotherapy in previously treated advanced KRAS G12D mutant pancreatic ductal adenocarcinoma (PDAC). Presented at: 2025 ESMO Congress; October 17-21, 2025; Berlin, Germany. Abstract: LBA84.
4. Cox AD, Fesik SW, Kimmelman AC, Luo J, Der CJ. Drugging the undruggable RAS: progress and challenges. Nat Rev Drug Discov. 2014;13:828–51.