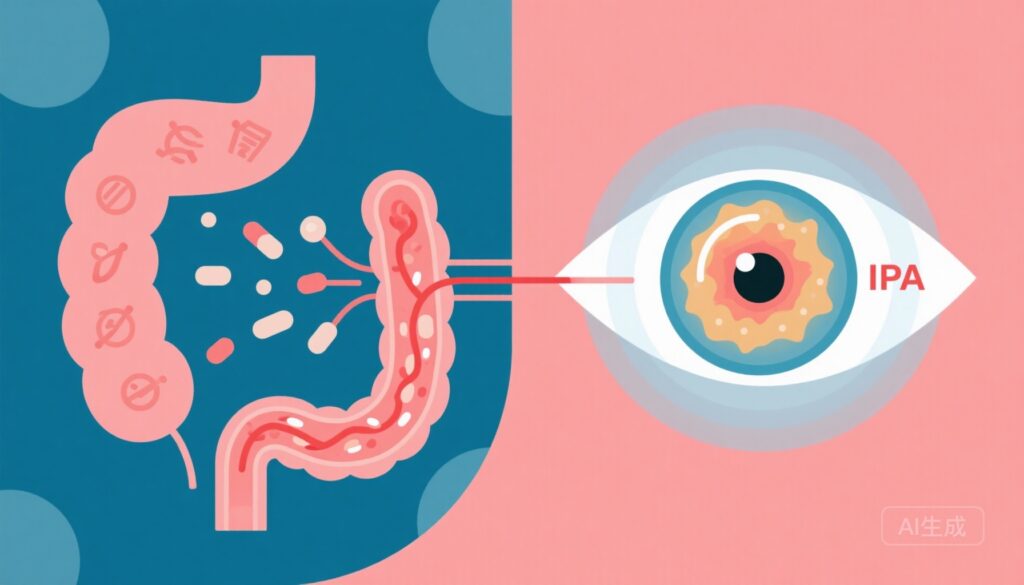
亮点
– 一项转化研究(Prasad等,Gut 2025)将肠道来源的吲哚-3-丙酸(IPA)与实验性2型糖尿病的视网膜保护联系起来,并显示糖尿病视网膜病变(DR)患者血液循环中的IPA较低。
– 两种恢复肠道色氨酸(Trp)吸收的策略——表达ACE2的乳酸菌副干酪亚种(Lactobacillus paracasei)和不依赖ACE2的色氨酸二肽(异亮氨酸-色氨酸,IW)——防止了db/db小鼠的DR,改善了代谢控制和肠道屏障完整性,并富集了色氨酸代谢细菌。
– 在2型糖尿病(T2D)患者中,DR与内毒素血症的生化证据和受损的肠道屏障标志物、较低的血清IPA和较高的吲哚硫酸盐水平相关,提示了一条致病性的肠道-视网膜轴,并可能成为生物标志物和治疗靶点。
背景:疾病负担和理由
糖尿病视网膜病变(DR)仍然是全球工作年龄成人视力丧失的主要原因。国际糖尿病联合会(IDF)估计,有数亿人患有糖尿病,且并发症负担不断增加,包括威胁视力的DR。目前的预防策略——血糖、血压和血脂控制加上筛查和及时的眼科治疗——虽然减少了但并未消除视力丧失。需要新的预防和早期干预方法,特别是那些在疾病发病机制上游进行干预的方法。
越来越多的证据表明,肠道微生物组改变、肠道屏障功能障碍和代谢物信号传导在代谢性疾病中起作用。色氨酸(Trp)既通过宿主途径(犬尿氨酸)也通过微生物途径代谢为吲哚和其他小分子。一些吲哚衍生物对黏膜完整性和系统稳态有有益影响,而另一些(如吲哚硫酸盐)则与毒性有关。了解特定的色氨酸衍生微生物代谢物是否影响DR可能会揭示生物标志物和新的治疗策略,这些策略可以远在视网膜上游发挥作用。
研究设计和方法
Prasad及其同事使用平行的临床前和人类观察方法测试恢复Trp吸收或递送Trp衍生代谢物是否会影响DR。
临床前(db/db小鼠模型)
– 模型:瘦素受体缺陷的db/db小鼠(2型糖尿病模型),容易发生代谢功能障碍和视网膜微血管疾病。
– 干预措施:使用两种口服策略增加Trp的生物利用度——(1)灌胃经基因改造的乳酸菌副干酪亚种,该菌株可保持肠道ACE2和钠偶联中性氨基酸转运蛋白,从而增强ACE2依赖的Trp吸收;(2)灌胃不依赖ACE2的Trp二肽(异亮氨酸-色氨酸,IW),通过肽转运蛋白SLC15A1(PEPT1)吸收。
– 治疗时间线:两种策略均作为预防(早期开始,持续6个月)和干预(较晚开始,持续3个月)进行了测试。
– 结果测量:肠道组织学和屏障功能、肠道微生物组组成、代谢指标(葡萄糖稳态、肠促胰岛素分泌)、视网膜结构和功能评估,包括空间质谱法绘制视网膜层内的代谢物。
人类队列
– 横断面对比成人血浆生物标志物:T2D合并DR(n=30)、T2D无DR(n=40)和健康对照组(n=35)。
– 测量:血浆Trp代谢物(包括IPA和吲哚硫酸盐)和血清学标志物(肠道通透性和内毒素血症)。
主要发现
临床前结果——db/db小鼠DR的预防和逆转
– 预防视网膜损伤:当用作长期预防疗法时,Lactobacillus paracasei-ACE2和IW二肽治疗均可防止db/db小鼠的糖尿病视网膜变化的发展,并在作为较短干预措施给予时产生有益效果。
– 恢复肠道生理:治疗纠正了糖尿病相关的菌群失调,选择性地富集了色氨酸代谢菌群,并改善了肠道屏障完整性。肠道通透性和内毒素血症的标志物减少。
– 代谢效应:治疗小鼠的葡萄糖稳态改善,肠促胰岛素分泌增加,这将恢复的肠道氨基酸处理与全身代谢益处联系起来。
– 视网膜代谢物定位:空间质谱法显示吲哚-3-丙酸(IPA)集中在视网膜色素上皮(RPE)层和后部血-视网膜屏障,表明在屏障完整性至关重要的区域局部积累。
– 机制意义:IPA被确定为介导RPE水平屏障保护的候选效应分子。尽管该研究未定义单一受体介导的途径,但IPA已知的抗氧化和屏障支持特性提供了生物学上的合理机制,将肠道来源的代谢物与视网膜保护联系起来。
人类观察结果
– DR中的循环代谢物改变:T2D合并DR患者的循环IPA水平低于无DR的T2D患者和健康对照组,且吲哚硫酸盐水平较高,后者在其他器官系统中与毒性有关。
– 肠漏和内毒素血症的证据:DR患者显示血清标志物升高,与肠道屏障破坏和内毒素血症一致,这支持了在小鼠中观察到的肠道-视网膜连接的转化相关性。
安全性和其他观察
– 在这项从临床前到人类的转化研究总结中,未报告具体的不良事件概况;然而,递送基因改造的益生菌和长期肽给药提出了可预测的安全性和监管考虑,需要在临床使用前进行严格的评估。
专家评论和解释
这项工作推进了一个令人信服的范式:一种肠道来源的微生物代谢物(IPA)可能是保护糖尿病视网膜屏障的生物标志物和介质。几点值得强调:
– 生物学合理性:IPA由特定的肠道细菌从饮食中的色氨酸产生。IPA具有已知的抗氧化特性,并与维持其他组织的屏障完整性有关。空间MS发现IPA集中在RPE中,直接提供了支持其保护作用的组织水平证据。
– 两种互补策略:研究表明,恢复Trp处理可以通过操纵宿主-微生物界面(ACE2保留益生菌)或绕过宿主依赖的运输(肽IW)来实现。两种方法都产生了有益的结果,加强了因果推断。
– 人类的临床信号:人类生物标志物数据——DR中较低的IPA和较高的吲哚硫酸盐——与临床前发现一致,支持IPA作为风险分层或治疗监测的候选循环生物标志物。
– 局限性和普遍性:临床前证据很强,但仅限于单个啮齿动物模型。Db/db小鼠重现了许多2型糖尿病的代谢特征,但不能模拟所有方面的人类DR。人类数据是横断面的,无法证明因果关系;药物(例如抗生素、二甲双胍)、饮食、肾功能和其他共病的影响可能影响循环代谢物。临床队列的样本量较小,需要在更大、前瞻性的队列中进行复制,并仔细控制混杂因素。
– 安全性和转化路径:基因改造的益生菌调节宿主ACE2或长期肽补充剂需要严格的安评、控制策略和监管审查。或者,直接补充纯化的IPA(作为营养保健品或药物)可能是一个更具吸引力、更可控的策略,但需要剂量、药代动力学和毒理学研究。
临床和研究意义
– 生物标志物开发:循环IPA有潜力成为非侵入性生物标志物,用于识别2型糖尿病患者中DR的高风险人群或监测针对肠道的干预反应。需要前瞻性验证。
– 治疗策略:出现了几条转化路径:(1)旨在恢复有益的Trp代谢的微生物定向疗法(益生菌、益生元、粪便微生物定向方法),(2)增加Trp生物利用度的肽或营养保健品方法(例如IW),以及(3)直接补充IPA。每条路径都需要定制的安全性和有效性测试。
– 试验设计考虑:应在早期DR或高风险2型糖尿病人群中进行随机、安慰剂对照试验,测量视网膜结构和功能终点(OCT、眼底摄影、视觉功能)、全身代谢结果、肠道通透性标志物和全面代谢组学,以建立因果效应和最佳剂量。
结论
Prasad等提供了临床前和人类证据,表明色氨酸代谢紊乱和微生物衍生代谢物吲哚-3-丙酸水平降低与糖尿病视网膜病变有关。通过ACE2保留益生菌或不依赖ACE2的Trp二肽恢复Trp处理,在小鼠模型中防止了DR,改善了全身代谢和肠道屏障功能,并使吲哚-3-丙酸在视网膜色素上皮中富集。横断面人类数据显示DR中IPA较低而吲哚硫酸盐较高,支持其转化相关性。这些发现将IPA确定为一种有前途的生物标志物,并指出了几种针对肠道的治疗策略,但临床转化需要前瞻性人类试验、严格的安全评估和机制澄清。
资金和临床试验注册
资金和试验注册详情见原始出版物:Prasad R等,Gut. 2025年11月5日。读者应查阅发表的论文以获取具体的资助和机构支持信息。本总结中未报告在ClinicalTrials.gov上注册的测试IPA补充剂治疗DR的人类干预试验;未来的临床开发应在此网站上注册计划试验。
参考文献
1. Prasad R, Adu-Rutledge Y, Ziani B, 等. 吲哚-3-丙酸将肠道功能障碍与糖尿病视网膜病变联系起来:一种生物标志物和新型治疗方法。Gut. 2025年11月5日:gutjnl-2025-336180. doi:10.1136/gutjnl-2025-336180. PMID: 41198173。
2. Cheung N, Mitchell P, Wong TY. 糖尿病视网膜病变。Lancet. 2010年7月10日;376(9735):124-36. doi:10.1016/S0140-6736(09)62124-3。
3. 国际糖尿病联合会. IDF糖尿病图谱,第10版. 2021. (用于流行病学和负担估计。)
4. Dodd D, 等. 肠道细菌途径将芳香族氨基酸代谢为循环代谢物。Cell Host Microbe. 2017;21(3):1-??. (描述了微生物芳香族氨基酸代谢为吲哚包括IPA的过程。)
作者注
本文综合了一项近期转化研究的结果,并将其置于临床背景下,旨在为临床医生、研究人员和卫生政策利益相关者提供信息。有关实验方法、原始数据和补充分析的详细信息,请参阅原始Gut文章和支持材料。