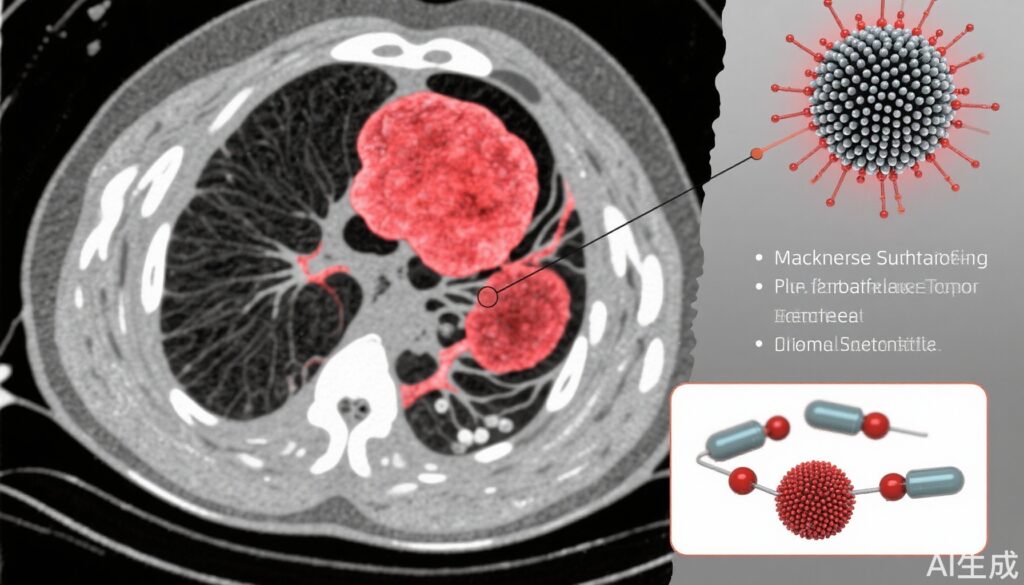
亮点
- 负载质子泵抑制剂 (PPI) 的硫化锰 (MS) 纳米平台可实现肿瘤酸中毒的实时磁共振成像 (MRI)。
- 该纳米平台在酸性肿瘤溶酶体中释放 Mn2+、H2S 和 PPI,诱导肿瘤酸中毒并增强 MRI 对比度。
- 肿瘤酸中毒与肿瘤消退呈正相关,可在传统结构成像之前更早地预测疗效。
- 纳米平台诱导的肿瘤酸中毒意外地抑制了肿瘤转移,突显了潜在的治疗益处。
研究背景和疾病负担
癌症仍然是全球发病率和死亡率的主要原因,肿瘤异质性对及时评估治疗反应提出了关键挑战。传统方法通常依赖于测量肿瘤质量的解剖或体积变化,这往往需要较长时间才能显现。这种延迟可能导致在疾病进展前错失调整治疗方案的机会。此外,肿瘤的酸性微环境是已知与肿瘤进展、侵袭性和治疗抵抗相关的标志。质子泵和代谢改变导致细胞外酸化,但非侵入性的实时评估肿瘤酸中毒仍然技术上具有挑战性。因此,临床上迫切需要创新的方法来动态映射肿瘤酸度,并提供早期的疗效见解,以便及时进行个体化治疗调整。
研究设计
本研究介绍了一种合理设计的基于硫化锰的纳米平台 (MSP),负载质子泵抑制剂 (PPI),旨在用于癌症的诊疗应用。MSP 的合成通过两步化学方法完成,涉及乙酰丙酮锰和硫代乙酰胺在乙二醇中的反应,生成直径约为 120 纳米的球形硫化锰纳米颗粒。使用透射电子显微镜 (TEM)、高分辨率 TEM、X 射线衍射 (XRD) 和 X 射线光电子能谱 (XPS) 表征了纳米平台的物理化学性质,包括形态、结晶度、表面化学和 pH 响应降解。
在不同 pH 条件下量化了 MSP 释放的功能成分——Mn2+、H2S 和 PPI,以模拟肿瘤溶酶体的酸性环境。使用硝酸银沉淀法验证了 H2S 的生成,并通过比色法评估了 Mn2+ 通过类芬顿反应产生的活性氧物质。进行了 MRI 松弛率 (r1) 测量,以确定 MSP 在不同 pH 条件下的 MRI 信号增强。
进一步在体外评估了纳米平台通过调节 PPI 负载比例(10%、25%、44%)来调节肿瘤酸中毒的效果,并评估了其对肿瘤细胞溶酶体 pH 值、葡萄糖代谢和乳酸生成的影响。系统分析了诱导的肿瘤酸中毒、纳米平台降解和 MRI 信号强度之间的相关性。此外,还研究了肿瘤酸中毒对肿瘤生长消退和转移潜力的影响。
主要发现
合成的硫化锰纳米颗粒表现出均匀的球形形态,结晶度高,与 MnS (002) 平面一致。XPS 确认了 Mn2+ 和硫化物离子的存在,支持了成功合成。酸触发降解研究表明,在较低 pH (pH 4.5) 下,MSP 分解增加,最大效率为 79.5%,释放 Mn2+、PPI 和 H2S。这种降解伴随着气泡的形成和明显的 H2S 气味,黑色 Ag2S 沉淀确认了 H2S 的生成。
释放的 Mn2+ 通过类芬顿反应催化羟基自由基 (•OH) 的生成,通过脱色和比色法证实,表明可能的细胞毒性效应,有助于抗肿瘤活性。重要的是,MRI 松弛率 (r1) 在酸性条件下显著增强,T1 加权 MRI 信号在 pH 4.5 时最高(8.243 mM−1 s−1),在中性 pH 时最低(1.628 mM−1 s−1),显示出明显的 pH 和剂量依赖性增加。
不同 PPI 负载比例的纳米平台成功地通过抑制 V-ATPase 泵和增加细胞内 H+ 浓度来诱导不同程度的肿瘤酸中毒。释放的 H2S 加强了肿瘤葡萄糖消耗,产生更多的乳酸,进一步加剧酸中毒,从而加速 MSP 降解和 MRI 信号增强,形成正反馈回路。关键在于,肿瘤酸中毒的程度与肿瘤消退指标呈正相关,能够在传统结构变化之前实时预测疗效。
意外的是,增加的肿瘤酸中毒还抑制了转移扩散,提供了额外的治疗优势。因此,该纳米平台通过同时监测肿瘤微环境酸度和调节肿瘤生理,桥接了诊断和治疗。
专家评论
这种创新的硫化锰纳米平台代表了肿瘤微环境成像和治疗监测领域的重要进展。实时、无创的肿瘤酸中毒 MRI 提供了反映肿瘤代谢状态和治疗反应的动态生物标志物,比传统的基于大小的标准要早得多。
机制上,利用肿瘤溶酶体酸化触发化合物释放并诱导代谢反馈回路,体现了精准纳米医学设计。此外,H2S 重塑肿瘤代谢的能力和 Mn2+ 类芬顿活性生成细胞毒性自由基,为纳米平台提供了多模式治疗效果。
局限性包括需要全面的体内验证、长期安全性评估以及在不同肿瘤模型中评估其普遍性。此外,临床转化还需要扩大合成规模和导航监管路径。尽管如此,将 pH 响应的 MRI 对比度和治疗释放集成在一个单一的纳米结构中,可能会改变实时癌症治疗监测和适应性治疗策略。
结论
负载质子泵抑制剂的硫化锰纳米平台是一种新型诊疗工具,可实现肿瘤酸中毒的实时 MRI 可视化。通过利用肿瘤溶酶体酸度释放治疗剂并增强 MRI 信号,该平台提供早期疗效预测,使临床医生能够动态调整治疗干预措施。通过 MRI 测量的肿瘤酸中毒与肿瘤消退之间的正相关性突显了这种方法的临床实用性。此外,观察到的转移抑制突显了额外的治疗潜力。未来的临床转化可能通过整合及时的诊断反馈和靶向代谢调节来优化癌症管理。
参考文献
1. Gillies RJ, Robey I, Gatenby RA. Causes and consequences of increased glucose metabolism of cancers. J Nucl Med. 2008;49 Suppl 2:24S-42S.
2. Webb BA, Chimenti M, Jacobson MP, Barber DL. Dysregulated pH: a perfect storm for cancer progression. Nat Rev Cancer. 2011;11(9):671-677.
3. Li W, Fan W, Bu W, et al. Smart manganese oxide nanoagents for magnetic resonance imaging-guided photothermal therapy. Chem Sci. 2017;8(3):1193-1200.
4. Neri D, Supuran CT. Interfering with pH regulation in tumours as a therapeutic strategy. Nat Rev Drug Discov. 2011;10(10):767-777.
5. Chen Z, Zhao P, Luo Z, et al. Glutathione-responsive disulfide bond-containing polymeric prodrug nanoplatforms for simultaneous diagnosis and therapy of tumors. Biomaterials. 2015;73:149-162.
6. DeBerardinis RJ, Chandel NS. Fundamentals of cancer metabolism. Sci Adv. 2016;2(5):e1600200.
7. Murphy MP. Targeting lipophilic cations to mitochondria. Biochim Biophys Acta. 2008;1777(7-8):1028-1031.
8. Chen H, Zeng X, Ma Y, et al. Targeting tumor hypoxia and reactive oxygen species for effective photodynamic therapy. Chem Soc Rev. 2021;50(20):11933-11955.