亮点
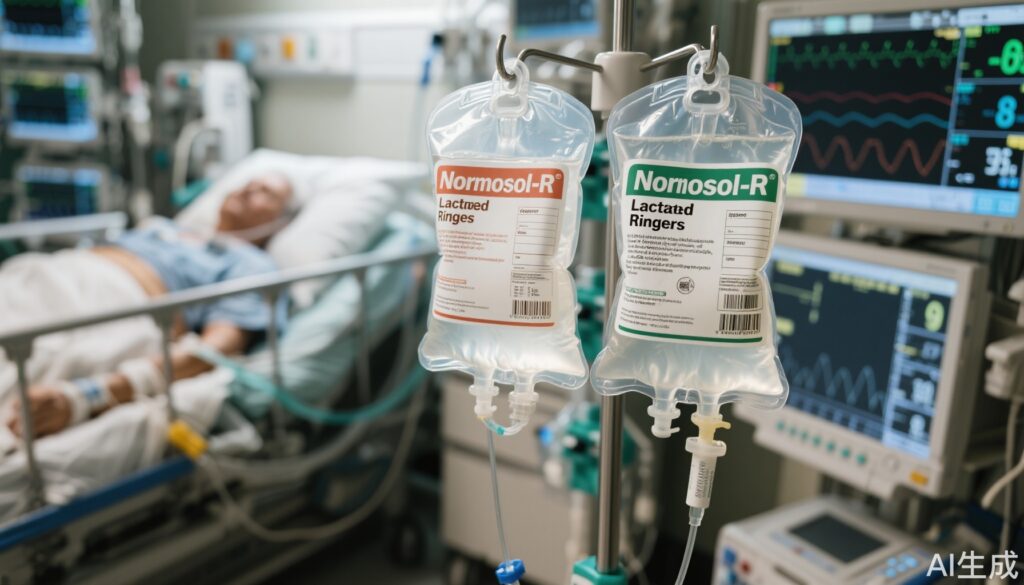
1. 这项大型、实用的随机试验比较了两种常用的平衡晶体液溶液(Normosol-R和乳酸林格氏液)对ICU重症成年患者的影响。
2. 7天内血浆碳酸氢盐水平无显著差异,表明两者对酸碱状态的影响相似。
3. 次要结局包括新的肾脏替代治疗和30天死亡率,在两组之间也具有可比性。
4. 这些发现表明,两种液体在该人群中的静脉输液治疗中提供同等的安全性和有效性。
研究背景与疾病负担
静脉输液治疗是管理重症患者的核心干预措施,通常涉及大量复苏。历史上,生理盐水(0.9%氯化钠)是首选液体,但由于平衡晶体液具有更好的生理组成,可以减少如高氯性代谢性酸中毒和急性肾损伤(AKI)等并发症,因此成为更优的选择。
平衡晶体液溶液(如乳酸林格氏液和Normosol-R)提供的电解质谱更接近血浆,并包含设计用于减轻酸碱失衡的缓冲剂。然而,它们在电解质和缓冲剂组成上的细微差异引发了是否一种溶液可能优于另一种的问题。鉴于液体选择在重症患者中与高发病率和死亡风险相关,阐明这些差异具有重要的临床意义。
研究设计
这项实用的、群组随机、多交叉试验在美国的一家学术医疗中心进行。研究在2018年6月1日至2019年1月31日期间招募了2,084名重症成年患者。根据每个时间段患者所在重症监护室(ICU)的群组分配,患者接受Normosol-R或乳酸林格氏液进行静脉输液治疗。
主要纳入标准包括需要在ICU环境中进行液体复苏的成年患者。主要结局是从入组到7天的血浆碳酸氢盐(HCO3-)浓度变化,作为酸碱状态的标志。次要结局包括住院期间开始肾脏替代治疗(KRT)和30天内的全因死亡率。
关键发现
研究队列的中位年龄为59岁,女性占48.3%,中位序贯器官衰竭评估(SOFA)评分为5,反映了明显的疾病严重程度。
关于主要结局,Normosol-R组和乳酸林格氏液组在7天内的血浆碳酸氢盐水平无显著差异(平均差异-0.12 mmol/dL;95% CI -0.61至0.36;P = .61)。这表明两种液体在重症患者中维持酸碱平衡的效果相似。
次要结局也显示出等效性。接受Normosol-R治疗的患者中有6.0%需要肾脏替代治疗,而乳酸林格氏液组为5.0%(绝对风险差异1.0%;95% CI -1.2%至3.1%),表明无统计学显著差异。30天死亡率在两组中几乎相同:16.3% vs 16.0%(绝对风险差异0.3%;95% CI -2.9%至3.6%)。
安全性特征一致,两组均未报告过多的特定液体相关的不良事件或并发症。
专家评论
这项样本量充足的试验提供了有力的证据,表明在重症成年患者中选择Normosol-R或乳酸林格氏液不会影响关键临床结局。之前关于电解质组成差异(如乳酸林格氏液中的钙或Normosol-R中的乙酸盐)的担忧并未转化为对酸碱稳态、肾功能或生存的有意义的临床影响。
群组交叉设计增强了内部有效性和最小化了患者层面变量的混杂因素。尽管该研究是在单一学术中心进行的,但其实用性质和真实的ICU环境支持其普遍适用性。
局限性包括可能未捕捉到罕见或长期效应,以及某些亚群体仍可能受益于定制的液体选择。进一步的研究可以探索特定条件(如创伤性脑损伤或严重的代谢紊乱)下的结局。
结论
对于需要静脉输液治疗的重症成年患者,Normosol-R和乳酸林格氏液在酸碱效应、肾脏替代治疗需求和短期死亡率方面具有临床等效性。临床医生可以选择任一平衡晶体液而不必担心影响这些重要结局。这项试验支持当前指南中推荐平衡晶体液,但基于这些结局,没有令人信服的证据表明应优先选择一种平衡溶液。
参考文献
Qian ET, Brown RM, Jackson KE, Wang L, Stollings JL, Freundlich RE, Wanderer JP, Siew ED, Bernard GR, Self WH, Casey JD, Rice TW, Semler MW; Pragmatic Critical Care Research Group. Normosol-R vs Lactated Ringers in the Critically Ill: A Randomized Trial. Chest. 2025 Aug;168(2):336-345. doi: 10.1016/j.chest.2025.02.008. Epub 2025 Feb 17. PMID: 39971001.