亮点
– 过量补充铁摄入与通过炎症途径加速表型衰老有关。
– 总铁摄入量与衰老之间存在U形关系,低于阈值时具有保护作用,超过阈值时则有害。
– 饮食中的铁本身不会加速衰老,突显了补充剂引起的铁过载风险。
– 抗炎和富含抗氧化剂的饮食可以抵消铁过载的促衰老效应。
– 炎症介导了因过量补充铁导致的衰老加速的显著部分(15.5%-25.6%)。
研究背景与疾病负担
铁是维持多种生物过程所必需的重要微量元素,包括氧气运输、DNA合成和细胞呼吸。然而,铁缺乏和铁过载都会带来严重的健康风险。随着全球人口老龄化,了解影响生物衰老的可调节因素变得至关重要。表型年龄是一个综合生物标志物,反映的是生物学年龄而非实际年龄,比单独的实际年龄更能准确预测发病率和死亡率风险。最近,人们对从膳食补充剂中摄取过量铁的关注增多,这些补充剂在许多人群中非常普遍,可能导致通过炎症和氧化应激机制对衰老产生不良影响。有趣的是,铁具有双重作用:它是不可或缺的,但过量时会催化活性氧(ROS)的形成,促进氧化损伤。尽管已经认识到这些双重作用,但来自不同来源的铁摄入量与表型衰老之间的关系,以及炎症或氧化途径在这一关系中的作用仍不清楚。
研究设计
这项横断面分析利用了2017-2018年全国健康和营养检查调查(NHANES)的数据,包括8692名20岁及以上的参与者。铁摄入量从饮食来源和补充剂两个方面进行了量化。主要终点是表型年龄加速(PhenoAgeAccel),基于经过验证的生物标志物算法得出。使用加权限制立方样条(RCS)建模了铁摄入量与PhenoAgeAccel之间的非线性关系。多变量调整的加权广义线性模型(GLMs)调整了混杂因素,以评估效应大小。K均值聚类识别了铁共暴露模式,根据铁摄入量特征将人群分为几组。使用似然比检验评估了抗炎或抗氧化潜力的饮食与铁的相互作用效应。为了探讨机制途径,中介分析量化了炎症和氧化应激生物标志物在铁过载与表型衰老关系中的贡献。额外的调整考虑了贫血状态和女性的绝经后状态,以控制潜在的混杂因素。
关键发现
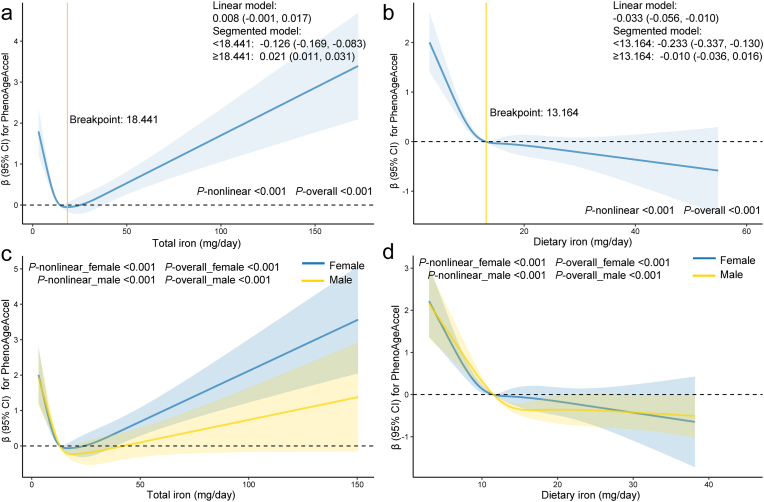
观察到总铁摄入量与PhenoAgeAccel之间存在稳健的U形关系,临界点为每天18.441毫克。低于此阈值时,增加的铁摄入量与减缓衰老相关(β = -0.126,表明衰老速度减慢),而超过此临界点时,则与表型衰老加速相关(β = 0.021)。重要的是,仅从饮食中获得的铁与衰老加速无关,表明在典型的饮食范围内是安全的。
相反,补充剂中的铁摄入量与PhenoAgeAccel呈显著正相关(β = 0.017),表明过量的补充铁可能促进衰老加速。分析未发现显著的性别交互作用。
K均值聚类将参与者分为两组:饮食铁参考(DIR)组,其总铁摄入量主要低于设定的上限(UL)45毫克/天,且补充剂中的铁摄入量极少;补充剂驱动的铁过载(SDIO)组,所有人的总铁摄入量均超过UL阈值,平均补充剂中的铁占总铁摄入量的83.44%。SDIO组的表型衰老速度明显快于DIR组(β = 1.774,P < 0.05),突显了补充剂驱动的铁过载的有害影响。
值得注意的是,摄入富含抗炎或抗氧化特性的饮食的参与者显示出显著的交互作用效应,这种饮食模式能够抵消铁相关的衰老加速(交互作用P = 0.025)。中介分析表明,炎症生物标志物部分介导了补充剂驱动的铁过载对加速衰老的不利影响,占这一效应的15.53%至25.63%。氧化应激标志物显示的中介效应较弱。
在控制了贫血和绝经后状态后,这些发现的稳健性依然存在,减少了这些条件造成的混杂风险。
专家评论
这项设计良好的流行病学研究为铁摄入量对生物衰老的复杂作用提供了宝贵的见解。其使用的大规模、全国代表性队列和复杂的建模方法增强了研究结果的可信度。U形曲线的识别在生物学上是合理的,反映了铁的狭窄治疗窗口——缺乏会损害生理功能,而过量则会引起氧化和炎症损伤。
区分饮食中的铁和补充剂中的铁在临床上非常重要。补充剂中的铁绕过了生理调节机制,可能导致系统性铁过载。这与先前文献中将铁过载状态与慢性炎症状况和与年龄相关的病理如心血管疾病和神经退行性疾病联系起来的观点一致。
炎症生物标志物的部分中介作用强调了慢性炎症,或“炎症衰老”,作为铁过量加速衰老的核心机制。这与更广泛的科学共识一致,即系统性炎症被认为是衰老的标志之一。
令人鼓舞的是,该研究强调了抗炎和抗氧化饮食在缓解铁诱导的衰老加速方面的潜力,支持营养干预作为可行的、低风险策略来保持健康衰老。然而,横断面设计限制了因果推断,且无法排除残余混杂因素。未来需要更多的纵向和干预研究来明确因果关系并测试饮食修改策略。
结论
这项研究有力地证明了过量的补充铁摄入,而不是饮食来源的铁,与通过炎症途径加速表型衰老有关。超过设定上限的补充剂驱动的铁过载显著增加了生物衰老的速度。然而,坚持抗炎或富含抗氧化剂的饮食模式可能抵消这些不良影响。临床医生应谨慎对待无临床缺铁人群的随意铁补充,并强调平衡营养以促进健康衰老。未来的研究应探索针对衰老人群调节铁稳态和炎症的干预措施。
参考文献
Li B, Ming Z, Wang Y, Zhang Y, Zhou R, Zhang C, Wu Y, Wang G, Xie H, Li Y, Li R. Supplement-driven iron overload accelerates phenotypic aging via inflammatory biomarkers: Potential counteraction through anti-inflammatory or antioxidant diets. Redox Biol. 2025 Sep;85:103733. doi: 10.1016/j.redox.2025.103733 . Epub 2025 Jun 19. PMID: 40570516 ; PMCID: PMC12246624 .
Ganz T. Iron homeostasis in host defence and inflammation. Nat Rev Immunol. 2016 Aug;16(8):566-78. doi: 10.1038/nri.2016.84 .
Lopez-Otin C, Blasco MA, Partridge L, Serrano M, Kroemer G. The Hallmarks of Aging. Cell. 2013 Jun 6;153(6):1194-217. doi: 10.1016/j.cell.2013.05.039 .
Calder PC, Ahluwalia N, Albers R, Bosco N, Bourdet-Sicard R, Haller D et al. A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr. 2013 Aug 28;109 Suppl 1:S1-34. doi: 10.1017/S0007114512005115 .