心肌炎和心包炎分别是影响心肌和心包的炎症性疾病。虽然这些疾病通常在年轻人中被识别,但流行病学数据显示其在所有年龄组中均有发生。这些疾病的病因多样,包括病毒感染、免疫介导的炎症性疾病(IMIDs)和与恶性肿瘤相关的因素;然而,相当一部分病例是特发性的。克隆性造血潜能未定(CHIP)反映了携带白血病相关突变的造血干细胞随年龄增长而扩增,但没有明显的恶性肿瘤。通常涉及DNMT3A和TET2基因,CHIP通过炎症途径促进心血管疾病的发展,但其与炎症性心脏疾病的关系尚未得到充分研究。
研究设计与方法
这项观察性队列研究分析了英国生物银行的数据,纳入了平均年龄约为56岁的335,426名参与者,这些参与者在基线时无心血管或血液恶性肿瘤,并有全外显子组测序数据。CHIP暴露包括任何变异等位基因频率(VAF)≥2%的克隆和VAF≥10%的大克隆,重点关注DNMT3A和TET2突变。主要结局是在中位随访13.6年期间通过诊断代码确定的心肌炎或心包炎。多变量Cox回归模型调整了人口统计学特征和心血管危险因素以测试关联。次要分析分别检查了心肌炎和心包炎,并将其发现与其他心血管疾病和IMIDs进行了比较。
主要发现
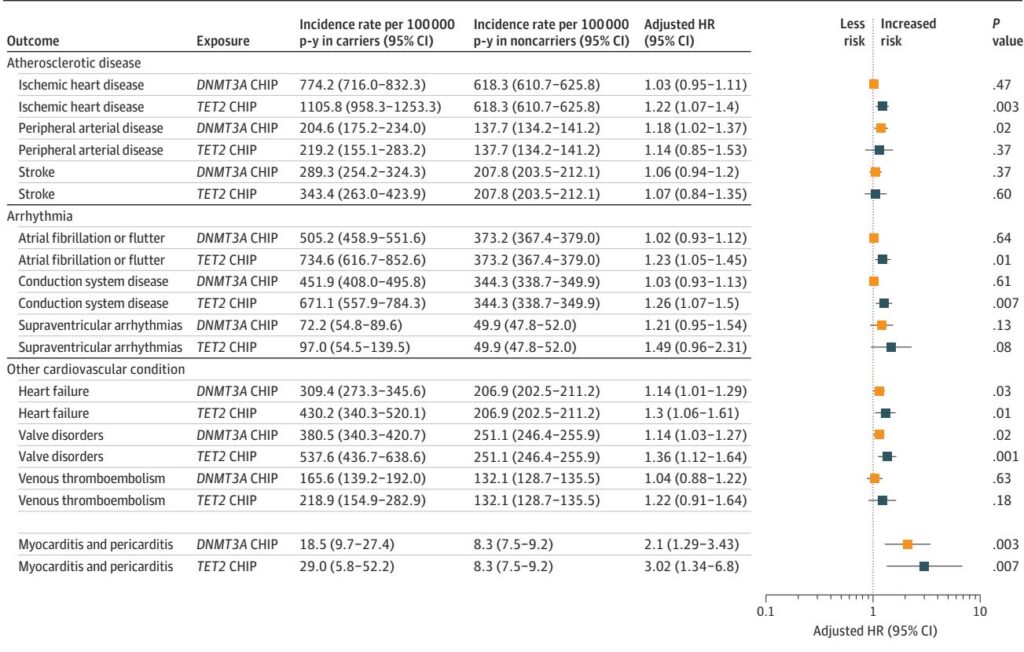
在参与者中,3.3%携带任何CHIP,2.2%有大克隆。随访期间,382人发展为心肌炎或心包炎。任何CHIP的存在与复合结局风险增加1.75倍(95% CI, 1.14–2.68;P=0.01)相关,大CHIP与风险增加2.07倍(95% CI, 1.28–3.33;P=0.003)相关。
基因特异性分析显示,DNMT3A突变与心包炎风险显著相关(HR 2.22;95% CI, 1.17–4.21),TET2突变与心肌炎相关(HR 3.65;95% CI, 1.16–11.49)。这些关联超过了已知的CHIP相关心血管疾病(如冠状动脉疾病和心力衰竭)的关联。CHIP还与非心脏IMIDs(HR 1.27;95% CI, 1.16–1.39)的风险适度升高相关,包括银屑病、类风湿关节炎和血管炎,尽管中介分析表明这些条件解释了不到1%的CHIP-心肌炎/心包炎关联。
敏感性分析一致支持这些发现,调整了癌症史、心血管事件和不同的结局定义。随着VAF和驱动突变数量的增加,剂量-反应关系明显,风险更大。
机制洞察与临床意义
实验模型表明,CHIP,特别是DNMT3A和TET2突变,通过激活NLRP3炎症小体和下游细胞因子IL-1β和IL-6参与心脏炎症。这些炎症途径有助于心肌炎和心包炎的发病机制,这一点在对IL-1阻断疗法有反应的难治性和复发性心包炎病例中得到了支持。
因此,CHIP代表了一种可能的新型机制,驱动着超出传统风险因素的炎症性心脏病。针对炎症的治疗策略,可能包括IL-1抑制,对于CHIP携带者尤其具有前景。
局限性
该研究依赖于全外显子组测序,可能低估了CHIP的患病率,特别是低VAF克隆。主要参与者为白种人,限制了普遍性。心肌炎和心包炎的罕见性限制了对详细亚组和基因特异性分析的能力,尤其是超出DNMT3A和TET2的分析。CHIP仅在基线时评估,无法检测到新的克隆扩张。尽管进行了全面调整,但仍不能完全排除残留混杂。基于管理代码的结局分类可能会引入误分类偏倚。
结论
在大型人群队列中,克隆性造血作为新发心肌炎和心包炎的重要独立风险因素出现,最强的关联见于DNMT3A和TET2突变以及较大的克隆大小。这些发现强调了体细胞造血突变在炎症性心脏疾病中的作用,突出了CHIP及其炎症途径作为预防和治疗策略的潜在靶点。进一步的机制和临床试验值得探索,以调整治疗由CHIP驱动的心肌炎和心包炎的炎症。
参考文献
Schuermans A, Flynn S, Niroula A, Uddin MM, Sinnaeve P, Budts W, Conrad N, Ebert BL, Libby P, Lin AE, Weber BN, Natarajan P, Honigberg MC. Clonal Hematopoiesis and Risk of New-Onset Myocarditis and Pericarditis. JAMA Cardiol. 2025 Aug 30. doi: 10.1001/jamacardio.2025.3369 IF: 14.1 Q1 . Epub ahead of print. PMID: 40884495 IF: 14.1 Q1 .