ハイライト
- 再発・難治性多発性骨髄腫(RRMM)患者の約3分の1(33%)が、単回のcilta-cel投与後に5年以上の無増悪生存(PFS)を達成しました。
- 長期生存者は、低い腫瘍負荷と高い効果細胞対標的細胞(E:T)比を含む特定のバイオマーカープロファイルを示しました。
- cilta-celは一貫した安全性プロファイルを維持し、5年間の追跡調査で新しい長期的安全性シグナルは確認されませんでした。
- この結果は、中位PFSが通常6ヶ月未満、中位全生存期間(OS)が約1年のRRMMの歴史的な期待に挑戦しています。
臨床背景と疾患負荷
多発性骨髄腫(MM)は、骨髄内のプラズマ細胞の悪性かつクローン性増殖であり、骨破壊、貧血、腎機能障害、免疫抑制により著しい病態を引き起こします。治療の進歩にもかかわらず、特にプロテアソーム阻害薬、免疫調整薬、抗CD38モノクローナル抗体に曝露された再発・難治性多発性骨髄腫(RRMM)患者は予後不良です。歴史的には、この集団の中位PFSは6ヶ月未満、中位OSは約1年です。B細胞成熟抗原(BCMA)を標的とするカイミック抗原受容体T細胞(CAR-T)療法の導入により、RRMMにおける反応の深さと持続性の改善への希望が生まれました。
Ciltacabtagene autoleucel (cilta-cel)は、第2世代のBCMA標的CAR-T療法です。初期フェーズ試験、特にCARTITUDE-1では、高全体反応率(ORR)と深い寛解が示されましたが、長期持続性と持続的利益の予測因子は不明でした。
研究方法
CARTITUDE-1は、プロテアソーム阻害薬、免疫調整薬、抗CD38抗体で治療に失敗したRRMM患者を対象としたオープンラベル、多施設フェーズ1b/2試験です。試験には、安全性と用量探索を目的としたフェーズ1b部分と、有効性(主終点:ORR)を評価するフェーズ2部分があります。その後、患者は最大15年間の疾患状態と生存の年次評価を行う長期フォローアップ試験CARTINUEに参加しました。
2018年7月から2019年10月まで、97人の患者が単回のcilta-cel投与を受けました。疾患進行は国際骨髄腫作業グループ(IMWG)基準に基づいて評価されました。主要な評価項目には、OSとPFS(Kaplan-Meier法による推定)が含まれます。免疫表型はフローサイトメトリーで解析され、血清バイオマーカー(可溶性BCMA [sBCMA]を含む)が測定されました。効果細胞対標的細胞(E:T)比は、CAR陽性T細胞のピークレベル(Cmax)を投与前のsBCMAレベルで割ったものです。安全性は継続的に監視され、感染症と神経学的有害事象が評価されました。
主要な知見
2025年2月時点(中央値追跡期間:61.3ヶ月)、47人が死亡し、3人が追跡不能となり、2人が進行により中止しました。45人(46.4%)が生存し、継続的な観察下にありました。全体の中央値OSは60.7ヶ月で、この高度に治療抵抗性の集団にとって驚異的な結果でした。
特筆すべきは、32人(33%)が単回のcilta-cel投与後に5年以上のPFSを経験し、さらなる抗骨髄腫治療を必要としなかったことです。そのうち31人は厳密な完全寛解(sCR)を達成しました。長期PFS達成者と早期進行者の基線特性は概ね類似していましたが、前者グループは腫瘍負荷(6.3% 対 17.4%)、sBCMA(36.0 mg/L 対 58.5 mg/L, P=0.117)、骨髄内プラズマ細胞浸潤(5.0% 対 24.0%, P=0.053)が低い傾向がありました。
バイオマーカー解析の結果は以下の通りでした:
– 5年以上のPFS群ではE:T比が高かった(P=0.008)。
– 5年以上のPFS群ではCAR+ T細胞Cmaxが高い(中央値 961/mL [四分位範囲 482-1380] 対 450/mL [246-1040], P=0.028)。
– 分離前の好中球対白血球比が低く、T細胞対好中球比が高い(P=0.03 および P=0.05)。
– 製品内のnaïve CAR+ T細胞の比率が高い(P=0.003)。
– 基線でのヘモグロビンと血小板数が高い(P=0.001 および P=0.049)。
– 鉄蛋白が低い傾向がある(P=0.158)。
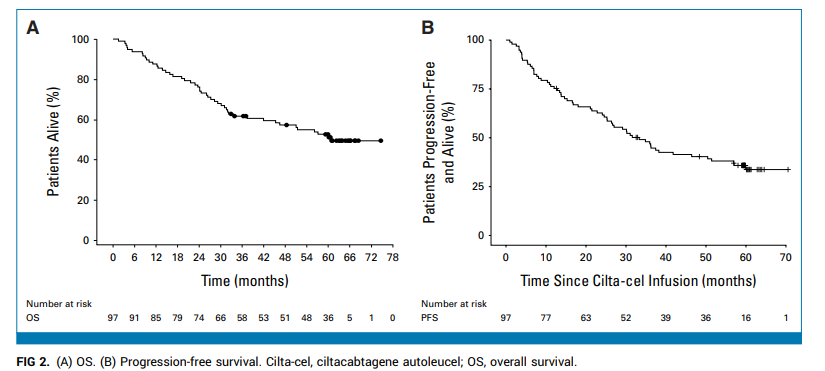
安全性に関して、5年以上のPFS群では二次原発悪性腫瘍(両方とも実質腫瘍)、神経学的有害事象2件、グレード≧3の感染症4件が報告されました。特に、パーキンソン病や脳神経麻痺の新たな報告はありませんでした。
メカニズムの洞察と生物学的妥当性
長期寛解と高いE:T比、CAR+ T細胞の大量増殖、製品中のnaïve T細胞の高含有量との関連性は、基線での腫瘍負荷とCAR-T細胞の品質が持続的な反応の重要な決定要因であることを示唆しています。低いsBCMAレベルと広範な骨髄浸潤の少なさは、CAR-T細胞の持続性と活性に有利な微小環境を反映している可能性があります。基線でのヘモグロビンと血小板数の高さは、病状が進行していない患者や骨髄予備力が高い患者がcilta-celからより多くの利益を得る可能性があるという仮説を支持しています。
専門家コメント
これらの知見はRRMM設定では前例がなく、患者の一部に機能的治癒の可能性を示唆しています。現在の専門家の共識は、BCMA標的CAR-T療法の変革的な可能性を強調していますが、患者選択の改善と現実世界での検証の必要性も指摘しています。ガイドラインは近い将来、これらのバイオマーカーを取り入れて適格性を精緻化し、結果を最適化する可能性があります。
論争点と制限
この研究は、単群デザイン、比較的小さなサンプルサイズ、ランダム化比較群の欠如などの制限があります。コホートは高度に治療抵抗性でしたが、すべてのRRMM集団を反映していない可能性があります。バイオマーカーの知見は仮説生成的であり、より大規模な独立コホートでの検証が必要です。長期リスク、特に二次悪性腫瘍については、引き続き慎重な監視が必要です。
結論
CARTITUDE-1研究は、単回のcilta-cel投与により、非常に難治性のMM患者の3分の1が5年以上の無増悪生存を達成できることを示しています。これは維持療法を必要とせず、RRMMの管理においてパラダイムシフトをもたらし、長期的な病態制御や甚至は治癒の希望を提供します。腫瘍負荷、E:T比、製品構成などの予測バイオマーカーの同定により、CAR-T療法がさらに個別化される可能性があります。今後の研究は、早期介入、併用戦略、長期安全性モニタリングに焦点を当てるべきです。
参考文献
1. Jagannath S, Martin TG, Lin Y, et al. Long-Term (≥5-Year) Remission and Survival After Treatment With Ciltacabtagene Autoleucel in CARTITUDE-1 Patients With Relapsed/Refractory Multiple Myeloma. J Clin Oncol. Published online June 3, 2025. doi:10.1200/JCO-25-00760 IF: 41.9 Q1 2. van de Donk NWCJ, Usmani SZ. CD38 Antibodies in Multiple Myeloma: Mechanisms of Action and Modes of Resistance. Front Immunol. 2018;9:2134.
3. Munshi NC, Anderson KC, Shah N, et al. Idecabtagene vicleucel in relapsed and refractory multiple myeloma. N Engl J Med. 2021;384(8):705-716.