背景
急性加重慢性肝衰竭(ACLF)是一种多方面的综合征,由慢性肝病患者的急性恶化引起,具有高短期死亡率和显著的全球健康影响。尽管已建立了多个区域性的诊断框架——如主要基于酒精和丙型肝炎人群的欧洲CLIF标准,以及在中国乙型肝炎病毒(HBV)流行地区开发的中国COSSH标准——目前仍缺乏一个适用于全球各种异质性ACLF病因的普遍接受的实用诊断和预后系统。鉴于流行病学趋势的变化,全球范围内丙型肝炎减少而酒精相关肝损伤增加,评估在不同人群中表现良好的框架对于统一临床实践和改善全球结果至关重要。
研究设计
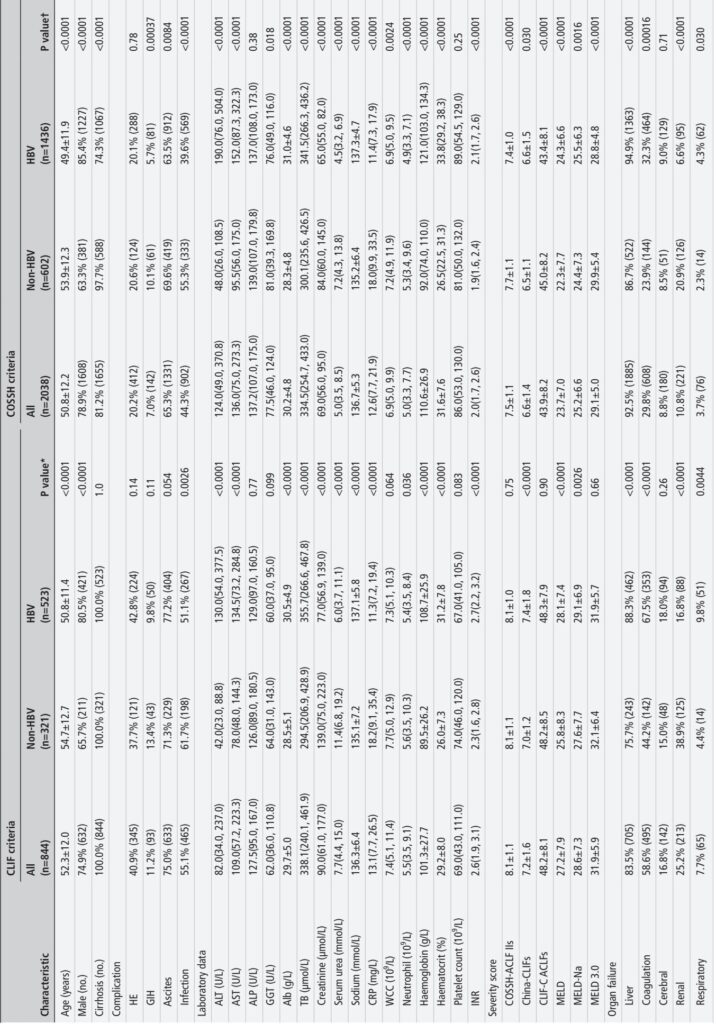
这项前瞻性多中心研究从2018年1月至2023年8月招募了5,288名因慢性肝病急性恶化的住院患者,代表了多种病因,包括HBV和非HBV原因(酒精、自身免疫、寄生虫、药物诱导和HCV相关病因)。患者入院时使用欧洲CLIF和中国COSSH诊断标准评估是否存在ACLF。研究还评估了七个预后评分——COSSH-ACLF II评分(COSSH-ACLF IIs)、中国-CLIFs(CLIF-C ACLFs修改版)、CLIF-C ACLFs、MELD、MELD-Na、MELD 3.0和NACSELD-ACLFs——对28天和90天无肝移植(LT)死亡率的预测性能。验证在三个大型非亚洲队列中进行,共4,072名来自欧洲和拉丁美洲(CANONIC、PREDICT、ACLARA)的患者。系统地收集和分析了广泛的临床、实验室和结局数据。
关键发现
1. 诊断性能: COSSH标准识别出2,038名ACLF患者(38.5%),明显高于CLIF标准识别的844名患者(16.0%)。COSSH标准捕获了额外22.6%的重症患者,这些患者表现出器官衰竭和显著的死亡率,其中包括14.2%的非HBV患者,这些患者未被CLIF标准识别。
2. 死亡率和严重程度分布: COSSH分类的ACLF患者显示出分级的28天/90天无LT死亡率(27.3%/41.0%),显著低于CLIF分类的患者(40.7%/57.0%),反映了COSSH包括病情较轻但临床上重要的患者。COSSH标准在ACLF 1至3级的分布上形成了更合理的金字塔状分布(63.4%/27.5%/9.1%),而CLIF则偏向于第2级(25.8%/56.3%/17.9%)。
3. 器官衰竭特征: 根据病因,器官衰竭模式存在差异,HBV-ACLF以更高的肝脏和凝血功能衰竭率为特征,而非HBV-ACLF患者则以肾功能衰竭为主。COSSH标准通过扩展纳入非肝硬化患者和单肝功能衰竭加升高的INR患者,更好地反映了这些差异。
4. 预后性能: COSSH-ACLF II评分在所有ACLF患者和病因中对28天和90天无LT死亡率预测的区分度优于CLIF-C ACLF和其他既定评分。它表现出优秀的校准性和有效的风险分层,分为低、中、高风险组,死亡风险显著不同。
5. 外部验证: 在非亚洲验证队列中,中国-CLIFs评分在预测主要为非HBV病因的肝硬化患者的死亡率方面与CLIF-C ACLF相当,显著优于基于MELD的模型和NACSELD-ACLFs。虽然由于缺少尿素数据,无法直接对外部验证COSSH-ACLF IIs,但匹配子集分析表明其预后准确性相当。
专家评论
这项全面的研究通过评估涵盖HBV和非HBV人群的ACLF病因谱的诊断和预后框架,填补了一个关键的空白,并在多样化的全球队列中进行了严格的验证。研究结果强调了现有标准的局限性,即要么漏诊(CLIF),要么专注于非常严重的病例(NACSELD),并确认了中国-CLIF框架(整合COSSH和CLIF元素)的增强敏感性和平衡特异性。
COSSH扩大的纳入标准捕获了更大比例的高风险患者,这些患者可能受益于早期强化管理和移植考虑。重要的是,COSSH-ACLF II预后评分在变量较少的情况下表现出优越的预测有效性,可能有助于更容易的临床实施。
然而,局限性包括潜在的区域诊断差异、依赖单个时间点评分而没有动态评估,以及需要在不同的医疗系统和新兴病因(如代谢功能障碍相关的脂肪性肝病[MASLD])中进行更广泛的外部验证。未来的工作整合多组学生物标志物可能会产生生物学驱动的分类,以改善ACLF的个性化管理。
结论
中国-CLIF框架提供了一个稳健且广泛适用的ACLF诊断和预后系统,对各种肝病病因和地理区域都具有敏感性。通过弥合亚洲和西方定义之间的差距,该框架为统一ACLF命名法、提高高风险患者的早期识别和指导治疗优先顺序提供了统一的基础。采用这一框架有望减少ACLF管理中的差异,并通过国际合作促进治疗进展。
参考文献
1. Arroyo V, Moreau R, Jalan R. Acute-on-Chronic Liver Failure. N Engl J Med. 2020;382:2137–45.
2. Moreau R, Gao B, Papp M, et al. Acute-on-chronic liver failure: A distinct clinical syndrome. J Hepatol. 2021;75:S27–35.
3. Wu T, Li J, Shao L, et al. Development of diagnostic criteria and a prognostic score for hepatitis B virus-related acute-on-chronic liver failure. Gut. 2018;67:2181–91.
4. Moreau R, Jalan R, Gines P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology. 2013;144:1426–37.
5. Jalan R, Yurdaydin C, Bajaj JS, et al. Toward an Improved Definition of Acute-on-Chronic Liver Failure. Gastroenterology. 2014;147:4–10.
6. Bernal W, Jalan R, Quaglia A, et al. Acute-on-chronic liver failure. Lancet. 2015;386:1576–87.
7. Sarin SK, Choudhury A. Acute-on-chronic liver failure: terminology, mechanisms and management. Nat Rev Gastroenterol Hepatol. 2016;13:131–49.
8. Karvellas CJ, Bajaj JS, Kamath PS, et al. AASLD Practice Guidance on Acute-on-chronic liver failure and the management of critically ill patients with cirrhosis. Hepatology. 2024;79:1463–502.
9. Luo J, Li J, Li P, et al. Acute-on-chronic liver failure: far to go—a review. Crit Care. 2023;27:259.
10. Zaccherini G, Weiss E, Moreau R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment. JHEP Rep. 2021;3:100176.