Giới thiệu
Bệnh Alzheimer (AD) vẫn là một rối loạn thần kinh thoái hóa chính, được đặc trưng bởi suy giảm nhận thức tiến triển và gánh nặng bệnh tật đáng kể trên toàn thế giới. Các yếu tố di truyền ảnh hưởng quan trọng đến sự dễ mắc AD, trong đó các biến thể của thụ thể gây ra trên tế bào bạch cầu hạt 2 (TREM2) và apolipoprotein E (apoE) nổi bật như những yếu tố nguy cơ mạnh mẽ nhất. TREM2, một thụ thể trên vi chất xám, điều chỉnh phản ứng miễn dịch và sự nuốt chửng, trong khi apoE, một vận chuyển lipid có ba isoform phổ biến (apoE2, apoE3 và apoE4), ảnh hưởng đến chuyển hóa amyloid beta và viêm thần kinh. Đáng chú ý, người mang apoE4 có nguy cơ mắc AD cao hơn và các quỹ đạo bệnh lý riêng biệt.
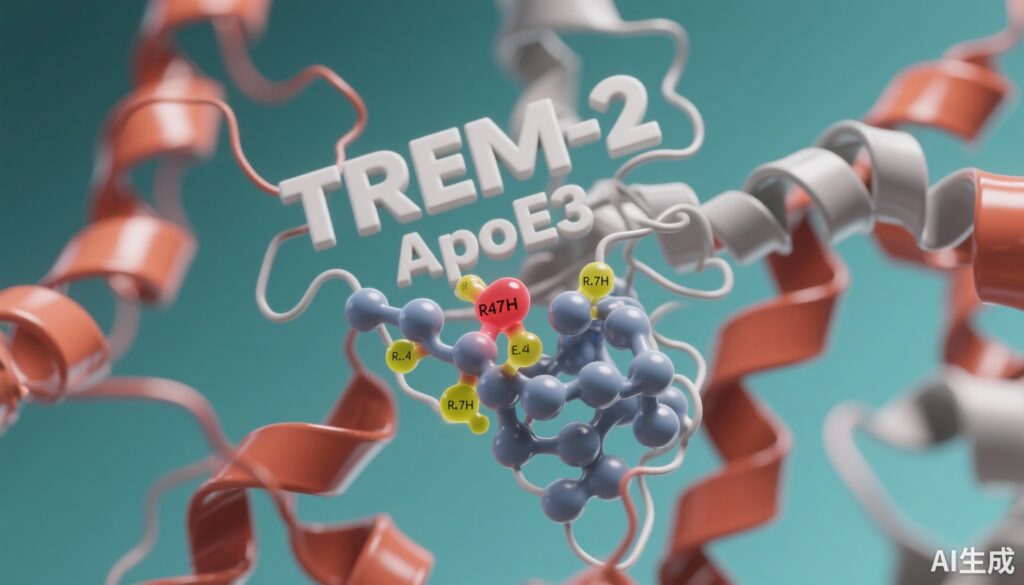
Các tương tác giữa TREM2 và apoE3 đã được chứng minh thực nghiệm, cho thấy rằng sự tương tác phân tử giữa các protein này ảnh hưởng đến chức năng của vi chất xám và sự tiến triển của AD. Tuy nhiên, các chi tiết cấu trúc chính xác của sự ràng buộc giữa TREM2-apoE3 và cách các biến thể liên quan đến AD—cụ thể là TREM2 R47H và apoE4—thay đổi sự tương tác phân tử này vẫn chưa được hiểu đầy đủ. Những hiểu biết này rất quan trọng để hiểu các cơ chế bệnh lý và phát triển các liệu pháp mục tiêu để điều chỉnh sự tương tác giữa TREM2-apoE trong AD.
Thiết kế nghiên cứu và phương pháp
Nghiên cứu này sử dụng các phương pháp tính toán kết hợp việc ghép protein-protein đồng thuận và mô phỏng động học phân tử (MD). Các phương pháp này nhằm tạo ra cấu trúc phức tạp ba chiều của TREM2 kết hợp với apoE3 phù hợp với dữ liệu thí nghiệm và kiểm tra tác động của các biến thể liên quan đến AD: TREM2 R47H và apoE4. Ghép protein xác định các giao diện tiềm năng và các chế độ ràng buộc dưới sự ràng buộc từ dữ liệu thí nghiệm, trong khi mô phỏng MD đánh giá sự ổn định và hành vi động của các phức hợp này.
Nghiên cứu cụ thể so sánh các cảnh quan cấu trúc và mạng lưới tương tác của các phức hợp TREM2-apoE3 hoang dại với những phức hợp có chứa đột biến R47H trên TREM2 và isoform apoE4 thay thế cho apoE3. Sự nhiễu loạn cấu trúc, sự gắn kết và xu hướng đa hóa được phân tích để làm rõ các hậu quả cơ chế của các đột biến này liên quan đến bệnh lý AD.
Kết quả chính
Cấu trúc phức hợp TREM2-apoE3 được xác định tiết lộ các điểm tương tác mới ngoài các điểm tiếp xúc đã được báo cáo trước đây. Các giao diện mới này hỗ trợ một cơ chế nhận dạng phân tử phức tạp hơn, ảnh hưởng đến cấu trúc protein. Sự ràng buộc của apoE3 gây ra sự thay đổi cấu trúc ở cả TREM2 và apoE3, chỉ ra sự thích ứng lẫn nhau quan trọng cho sự tương tác hiệu quả và tín hiệu vi chất xám có thể chức năng.
Biến thể TREM2 R47H liên quan đến AD được phát hiện thay đổi chế độ ràng buộc apoE3 điển hình. Cụ thể, sự thay thế R47H chuyển sự ràng buộc apoE3 đến một khu vực của TREM2 liên quan đến sự đa hóa thụ thể, có thể can thiệp vào sự đa hóa TREM2 và tín hiệu tiếp theo. Sự chuyển dịch không gian này có thể giúp giải thích hiện tượng mất chức năng liên quan đến R47H và nguy cơ mắc AD tăng lên.
Sự thay thế apoE3 bằng apoE4 làm mất ổn định sự nguyên vẹn cấu trúc của cả hai thành phần trong phức hợp. ApoE4 thể hiện sự ổn định ràng buộc giảm và thúc đẩy sự dao động cấu trúc trong TREM2, có thể làm suy giảm chức năng thụ thể và các tương tác với ligand. Sự mất ổn định này phù hợp với nguy cơ mắc AD tăng lên và sự tiến triển bệnh nhanh hơn được quan sát ở người mang apoE4.
Bình luận chuyên gia và hiểu biết cơ chế
Sự tích hợp của phân tích cấu trúc và động học trong nghiên cứu này đóng góp hiểu biết cơ chế quan trọng về cách các biến thể di truyền ảnh hưởng đến sự tương tác giữa TREM2-apoE. Với vai trò của TREM2 trong phản ứng vi chất xám đối với tổn thương tế bào thần kinh và bệnh lý amyloid, sự gián đoạn trong sự ràng buộc TREM2-apoE có khả năng điều chỉnh các trạng thái kích hoạt vi chất xám và viêm thần kinh trong AD.
Quan sát rằng đột biến R47H định vị lại sự ràng buộc apoE3 hướng đến một giao diện đa hóa gợi ý một cơ chế mà biến thể này giảm sự tụ tập của TREM2 và cường độ tín hiệu. Tương tự, sự mất ổn định do apoE4 gây ra có thể làm suy giảm chức năng nhận dạng và thanh thải ligand. Các nhiễu loạn cấu trúc này cung cấp cơ sở sinh học hợp lý liên kết các biến thể này với bệnh lý AD.
Mặc dù thuyết phục, nhưng các kết quả này xuất phát từ các mô hình in silico cần được xác nhận thực nghiệm thông qua các xét nghiệm vật lý sinh học và tế bào. Ngoài ra, sự phức tạp của các chức năng của TREM2 và apoE trong vivo liên quan đến các yếu tố đồng tác động khác và các đường dẫn tiếp theo cần được nghiên cứu thêm.
Kết luận và ý nghĩa lâm sàng
Nghiên cứu này nâng cao hiểu biết về sự tương tác giữa TREM2-apoE3 ở cấp độ phân tử và minh họa cách các biến thể TREM2 R47H và apoE4 liên quan đến AD thay đổi động lực ràng buộc và sự ổn định cấu trúc. Việc xác định các giao diện tương tác mới và các hiệu ứng cấu trúc cung cấp nền tảng cho thiết kế liệu pháp hợp lý nhằm khôi phục hoặc điều chỉnh sự tương tác giữa TREM2-apoE ở bệnh nhân mang các alen nguy cơ cao.
Nhắm mục tiêu vào các khuyết tật phân tử cụ thể này hứa hẹn các can thiệp cá nhân hóa AD có thể cải thiện chức năng vi chất xám, giảm viêm thần kinh và làm chậm sự tiến triển của bệnh. Nghiên cứu đa ngành tích hợp sinh học cấu trúc, thí nghiệm chức năng và nghiên cứu lâm sàng trong tương lai sẽ thiết yếu để chuyển đổi những hiểu biết này thành các liệu pháp hiệu quả cho AD.
Tài liệu tham khảo
Greer RA, Tuckey RA, Dean HB, Brett TJ, Roberson ED, Song Y. Tương tác giữa TREM2-apoE3 và bệnh Alzheimer: Hiểu biết phân tử và cấu trúc và tác động của các biến thể TREM2 R47H và apoE4. Alzheimers Dement. 2025 Oct;21(10):e70729. doi: 10.1002/alz.70729. PMID: 41085188; PMCID: PMC12519512.