Nền tảng
Suy gan cấp trên nền mạn tính (ACLF) là một hội chứng phức tạp xuất phát từ sự suy giảm cấp tính ở bệnh nhân mắc bệnh gan mạn tính do nhiều nguyên nhân khác nhau, với tỷ lệ tử vong ngắn hạn cao và tác động đáng kể đến sức khỏe toàn cầu. Mặc dù đã có nhiều khung chẩn đoán được thiết lập theo khu vực—như tiêu chuẩn CLIF của châu Âu chủ yếu dựa trên dân số mắc bệnh gan do rượu và viêm gan C, và tiêu chuẩn COSSH của Trung Quốc được phát triển trong bối cảnh viêm gan B (HBV)—hiện chưa có hệ thống chẩn đoán và tiên lượng thực tế nào được chấp nhận rộng rãi và áp dụng trên toàn thế giới đối với các nguyên nhân đa dạng của ACLF. Trước xu hướng dịch tễ học đang thay đổi với tỷ lệ mắc viêm gan C giảm và bệnh gan do rượu tăng trên toàn cầu, việc đánh giá các khung chẩn đoán hiệu quả trên các dân số đa dạng là cần thiết để thống nhất thực hành lâm sàng và cải thiện kết quả toàn cầu.
Thiết kế nghiên cứu
Nghiên cứu này là một nghiên cứu đa trung tâm triển vọng, tuyển chọn 5.288 bệnh nhân nhập viện do tình trạng suy giảm cấp tính của bệnh gan mạn tính từ tháng 1 năm 2018 đến tháng 8 năm 2023, đại diện cho các nguyên nhân đa dạng bao gồm HBV và các nguyên nhân không phải HBV (rượu, tự miễn, ký sinh trùng, do thuốc, và do viêm gan C). Bệnh nhân được đánh giá tại thời điểm nhập viện về sự hiện diện của ACLF bằng cả tiêu chuẩn chẩn đoán CLIF của châu Âu và COSSH của Trung Quốc. Nghiên cứu cũng đánh giá hiệu suất của bảy điểm tiên lượng—điểm COSSH-ACLF II (COSSH-ACLF IIs), China-CLIFs (được sửa đổi từ CLIF-C ACLFs), CLIF-C ACLFs, MELD, MELD-Na, MELD 3.0, và NACSELD-ACLFs—để dự đoán tỷ lệ tử vong không ghép gan (LT) sau 28 ngày và 90 ngày. Việc xác nhận đã được thực hiện trên ba nhóm không phải người châu Á lớn với tổng số 4.072 bệnh nhân từ châu Âu và Nam Mỹ (CANONIC, PREDICT, ACLARA). Dữ liệu lâm sàng, phòng thí nghiệm và kết quả được thu thập và phân tích một cách có hệ thống.
Kết quả chính
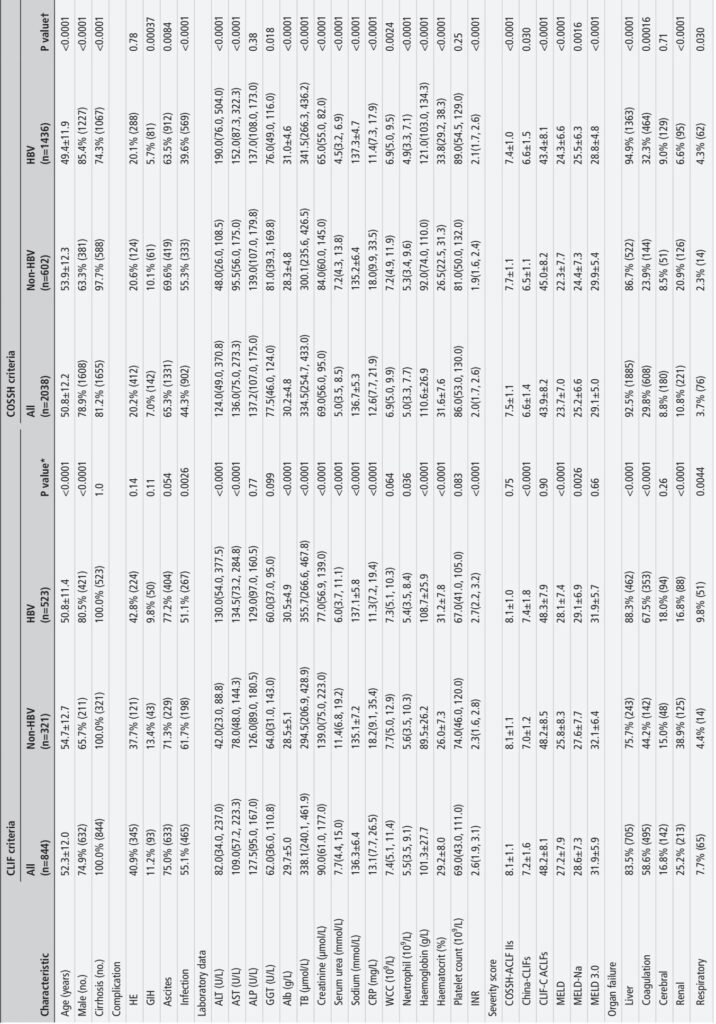
1. Tính năng chẩn đoán: Tiêu chuẩn COSSH đã xác định 2.038 bệnh nhân ACLF (38,5%), cao hơn đáng kể so với 844 bệnh nhân (16,0%) được xác định bằng tiêu chuẩn CLIF. Tiêu chuẩn COSSH đã phát hiện thêm 22,6% bệnh nhân nguy kịch có dấu hiệu suy tạng và tỷ lệ tử vong cao, bao gồm 14,2% bệnh nhân không phải HBV bị bỏ sót bởi tiêu chuẩn CLIF.
2. Tỷ lệ tử vong và phân bố mức độ nặng: Bệnh nhân ACLF được phân loại theo COSSH có tỷ lệ tử vong không ghép gan sau 28 ngày/90 ngày theo cấp độ (27,3%/41,0%), thấp hơn đáng kể so với bệnh nhân được phân loại theo CLIF (40,7%/57,0%), phản ánh việc COSSH bao gồm bệnh nhân có mức độ nặng nhẹ hơn nhưng vẫn quan trọng về mặt lâm sàng. Tiêu chuẩn COSSH tạo ra một phân bố hình chóp kim tự tháp hợp lý hơn qua các cấp độ 1 đến 3 của ACLF (63,4%/27,5%/9,1%) so với CLIF nghiêng về cấp độ 2 (25,8%/56,3%/17,9%).
3. Hồ sơ suy tạng: Sự khác biệt về mẫu suy tạng được quan sát theo nguyên nhân, với ACLF do HBV đặc trưng bởi tỷ lệ suy gan và rối loạn đông máu cao hơn, trong khi bệnh nhân ACLF không phải HBV biểu hiện chủ yếu là suy thận. Tiêu chuẩn COSSH phản ánh tốt hơn những khác biệt này bằng cách mở rộng tiêu chí bao gồm bệnh nhân không xơ gan và những bệnh nhân có suy gan đơn độc kèm theo INR tăng.
4. Tính năng tiên lượng: Điểm COSSH-ACLF II thể hiện khả năng phân biệt ưu việt trong việc dự đoán tỷ lệ tử vong không ghép gan sau 28 ngày và 90 ngày cho tất cả bệnh nhân và nguyên nhân ACLF, vượt trội hơn so với CLIF-C ACLF và các điểm số đã được thiết lập khác. Nó cho thấy hiệu chỉnh tốt và phân tầng rủi ro hiệu quả thành các nhóm rủi ro thấp, trung bình và cao với tỷ lệ tử vong khác biệt đáng kể.
5. Xác nhận bên ngoài: Trong các nhóm xác nhận không phải người châu Á, điểm China-CLIFs hoạt động tương đương với CLIF-C ACLF trong việc dự đoán tỷ lệ tử vong ở bệnh nhân xơ gan chủ yếu do nguyên nhân không phải HBV, vượt trội đáng kể so với các mô hình dựa trên MELD và NACSELD-ACLFs. Mặc dù việc xác nhận bên ngoài trực tiếp của COSSH-ACLF IIs không thể thực hiện được do thiếu dữ liệu urea, một phân tích tập con phù hợp đã chỉ ra độ chính xác tiên lượng tương đương.
Bình luận chuyên gia
Nghiên cứu toàn diện này giải quyết một khoảng trống quan trọng bằng cách đánh giá các khung chẩn đoán và tiên lượng trên toàn phổ các nguyên nhân của ACLF, bao gồm cả dân số HBV và không phải HBV, với việc xác nhận nghiêm ngặt trên các nhóm đa dạng toàn cầu. Kết quả nhấn mạnh những hạn chế của các tiêu chí hiện tại hoặc chẩn đoán quá ít (CLIF) hoặc tập trung vào các trường hợp rất nặng (NACSELD), và khẳng định tính nhạy cảm được cải thiện và độ đặc hiệu cân đối của khung China-CLIF (tích hợp các yếu tố của COSSH và CLIF).
Việc mở rộng tiêu chí bao gồm của COSSH bao gồm một phần lớn hơn của bệnh nhân có nguy cơ cao có thể hưởng lợi từ quản lý cường độ cao sớm hoặc xem xét ghép gan. Điều quan trọng là, điểm tiên lượng COSSH-ACLF II có độ chính xác dự đoán ưu việt với ít biến số hơn có thể giúp dễ dàng triển khai lâm sàng hơn.
Tuy nhiên, các hạn chế bao gồm khả năng biến đổi chẩn đoán theo khu vực, sự phụ thuộc vào điểm đánh giá đơn thời điểm mà không có đánh giá động, và nhu cầu xác nhận bên ngoài rộng rãi hơn trên các hệ thống y tế khác nhau và các nguyên nhân mới nổi như bệnh gan mỡ liên quan đến rối loạn chức năng chuyển hóa (MASLD). Công việc trong tương lai tích hợp các dấu hiệu sinh học đa omics có thể tạo ra các phân loại dựa trên sinh học để cải thiện quản lý cá nhân hóa của ACLF.
Kết luận
Khung China-CLIF cung cấp một hệ thống chẩn đoán và tiên lượng vững chắc, có thể áp dụng rộng rãi cho ACLF, nhạy cảm trên các nguyên nhân đa dạng của bệnh gan mạn tính và địa lý. Bằng cách bắc cầu các khoảng cách trước đây giữa các định nghĩa của châu Á và phương Tây, nó cung cấp một nền tảng thống nhất để đồng bộ hóa thuật ngữ ACLF, cải thiện việc xác định sớm bệnh nhân có nguy cơ, và thông báo ưu tiên điều trị toàn cầu. Việc áp dụng khung này hứa hẹn sẽ giảm bất bình đẳng trong quản lý ACLF và thúc đẩy sự tiến bộ điều trị thông qua hợp tác quốc tế.
Tài liệu tham khảo
1. Arroyo V, Moreau R, Jalan R. Acute-on-Chronic Liver Failure. N Engl J Med. 2020;382:2137–45.
2. Moreau R, Gao B, Papp M, et al. Acute-on-chronic liver failure: A distinct clinical syndrome. J Hepatol. 2021;75:S27–35.
3. Wu T, Li J, Shao L, et al. Development of diagnostic criteria and a prognostic score for hepatitis B virus-related acute-on-chronic liver failure. Gut. 2018;67:2181–91.
4. Moreau R, Jalan R, Gines P, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology. 2013;144:1426–37.
5. Jalan R, Yurdaydin C, Bajaj JS, et al. Toward an Improved Definition of Acute-on-Chronic Liver Failure. Gastroenterology. 2014;147:4–10.
6. Bernal W, Jalan R, Quaglia A, et al. Acute-on-chronic liver failure. Lancet. 2015;386:1576–87.
7. Sarin SK, Choudhury A. Acute-on-chronic liver failure: terminology, mechanisms and management. Nat Rev Gastroenterol Hepatol. 2016;13:131–49.
8. Karvellas CJ, Bajaj JS, Kamath PS, et al. AASLD Practice Guidance on Acute-on-chronic liver failure and the management of critically ill patients with cirrhosis. Hepatology. 2024;79:1463–502.
9. Luo J, Li J, Li P, et al. Acute-on-chronic liver failure: far to go—a review. Crit Care. 2023;27:259.
10. Zaccherini G, Weiss E, Moreau R. Acute-on-chronic liver failure: Definitions, pathophysiology and principles of treatment. JHEP Rep. 2021;3:100176.