Tổng quan
Thử nghiệm lâm sàng ngẫu nhiên này đánh giá một phương pháp xạ trị mới – xác định mục tiêu đã được điều chỉnh hướng dẫn bằng MRI đa chế độ và tractography mô trắng kết hợp với xạ trị tăng cường đồng thời giảm phân liều vừa phải (HSIB-IMRT) – trong ung thư não cấp cao (HGG). Nghiên cứu cho thấy kỹ thuật này giảm đáng kể thể tích mục tiêu lâm sàng mà không làm giảm thời gian sống còn không tiến triển (PFS), thời gian sống còn tổng thể (OS) hoặc tăng tái phát ngoài vùng chiếu xạ. Các hồ sơ an toàn tương đương với điều trị tiêu chuẩn, nhấn mạnh tiềm năng của xạ trị tiết kiệm thể tích cá nhân hóa để giảm thiểu độc tính thần kinh trong quản lý HGG.
Nền tảng nghiên cứu và gánh nặng bệnh tật
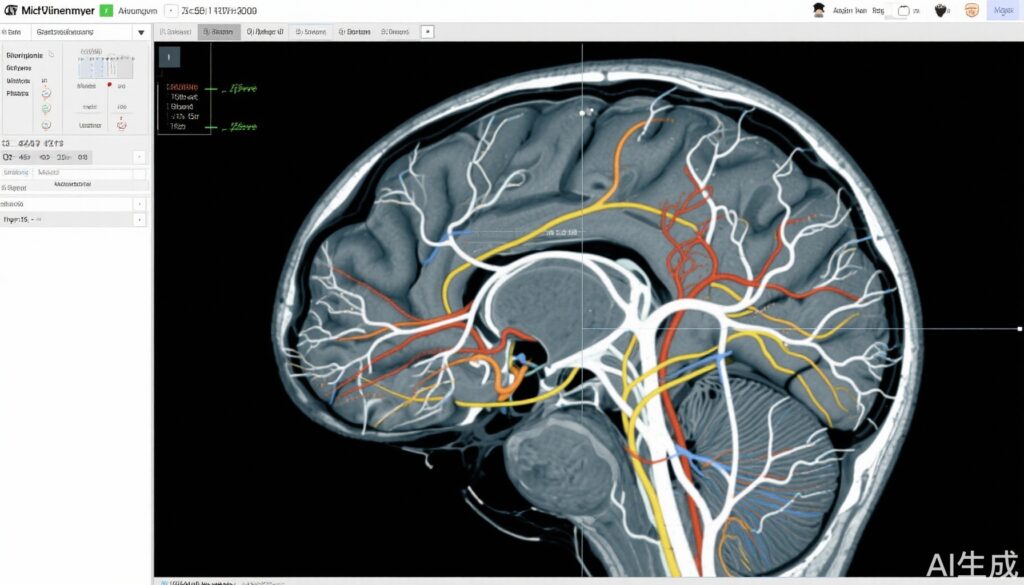
Ung thư não cấp cao (HGG), bao gồm u đa hình dạng glioblastoma và u gli anaplasi, vẫn là một trong những khối u não nguyên phát hung hãn và gây tử vong nhất. Mặc dù có phương pháp điều trị đa chế độ kết hợp phẫu thuật cắt bỏ an toàn tối đa, xạ trị và hóa trị liệu temozolomide, thời gian sống sót trung bình hiếm khi vượt quá hai năm. Xạ trị là trụ cột của quản lý; tuy nhiên, thể tích mục tiêu chiếu xạ tối ưu và lịch trình liều lượng vẫn là lĩnh vực nghiên cứu đang diễn ra. Theo truyền thống, các thể tích mục tiêu lâm sàng (CTVs) rộng được xác định để bao gồm các vùng xâm lấn vi mô của khối u, thường dẫn đến phơi nhiễm mô não khỏe mạnh và tăng nguy cơ độc tính thần kinh. Với sự tiến bộ trong chẩn đoán hình ảnh thần kinh, bao gồm MRI đa chế độ và hình ảnh tensor khuếch tán xác định tractography mô trắng, có hứa hẹn để định vị chính xác hơn các đường lây lan khối u, cho phép xác định mục tiêu xạ trị chọn lọc hơn.
Hơn nữa, lịch trình phân liều có ý nghĩa quan trọng đối với hiệu quả và độc tính. Xạ trị giảm phân liều vừa phải, cung cấp liều lượng lớn hơn một chút mỗi lần phân liều với kỹ thuật tăng cường đồng thời, có thể cải thiện kiểm soát khối u mà không tăng độc tính. Do đó, có nhu cầu chưa được đáp ứng để tinh chỉnh cả thể tích chiếu xạ và lịch trình phân liều để cải thiện kết quả lâm sàng và chất lượng cuộc sống cho bệnh nhân HGG.
Thiết kế nghiên cứu
Đây là một thử nghiệm lâm sàng ngẫu nhiên, mở nhãn, triển vọng, đơn trung tâm được thực hiện tại một trung tâm y tế Trung Quốc. Tổng cộng 154 bệnh nhân từ 18 đến 70 tuổi với chẩn đoán mô học xác nhận, mới mắc ung thư não cấp cao đã được tuyển dụng từ tháng 1 năm 2018 đến tháng 8 năm 2022, với việc theo dõi hoàn thành vào tháng 6 năm 2024.
Bệnh nhân được ngẫu nhiên hóa thành hai nhóm:
- Nhóm thử nghiệm: Xác định mục tiêu được điều chỉnh và hướng dẫn bằng các kỹ thuật MRI đa chế độ (bao gồm MRI cường độ T1 có tiêm thuốc cản quang, chuỗi T2/FLAIR) tích hợp với tractography mô trắng để xác định các đường lây lan khối u. Điều này được kết hợp với xạ trị tăng cường đồng thời giảm phân liều vừa phải (HSIB-IMRT), cung cấp liều lượng tăng cường cao hơn cho các vùng rủi ro cao trong thể tích khối u thô trong khi sử dụng thể tích mục tiêu tổng thể nhỏ hơn.
- Nhóm tiêu chuẩn: Bệnh nhân nhận xạ trị IMRT tiêu chuẩn dựa trên các thể tích mục tiêu lâm sàng được khuyến nghị bởi các hướng dẫn hiện hành mà không tích hợp các sửa đổi hướng dẫn bởi hình ảnh tiên tiến.
Cả hai nhóm đều nhận hóa trị liệu temozolomide đồng thời trong quá trình xạ trị và hóa trị liệu bổ trợ sau đó, theo nguyên tắc của giao thức Stupp.
Điểm cuối chính là thời gian sống còn không tiến triển (PFS), được định nghĩa là thời gian từ khi ngẫu nhiên hóa đến tiến triển bệnh hoặc tử vong. Điểm cuối phụ bao gồm thời gian sống còn tổng thể (OS) và an toàn, tập trung vào các tác dụng phụ liên quan đến điều trị.
Kết quả chính
Trong số 154 bệnh nhân được đăng ký, thời gian theo dõi trung bình là 22 tháng (khoảng 4-76 tháng), với 96 ca tử vong được ghi nhận vào cuối nghiên cứu. Đặc điểm cơ bản bao gồm độ tuổi (trung bình 51.5 tuổi) và phân bố giới tính (55.2% nam) là tương đương giữa các nhóm.
Thời gian sống còn không tiến triển: Thời gian PFS trung bình là 15.5 tháng (95% CI, 11.7-19.3 tháng) trong nhóm thử nghiệm so với 13.5 tháng (95% CI, 8.7-18.3 tháng) trong nhóm tiêu chuẩn, không có sự khác biệt thống kê đáng kể (P = .89).
Thời gian sống còn tổng thể: Thời gian OS trung bình là 27.0 tháng (95% CI, 13.9-40.1 tháng) trong nhóm thử nghiệm và 21.0 tháng (95% CI, 18.0-24.0 tháng) trong nhóm tiêu chuẩn. Sự khác biệt này không đạt mức thống kê đáng kể (P = .24), nhưng có lợi thế về mặt số học cho phương pháp thử nghiệm.
Thể tích mục tiêu lâm sàng: Các CTV trung bình trong nhóm thử nghiệm nhỏ hơn đáng kể so với nhóm tiêu chuẩn (CTV1 trung bình 116.7 cm3 so với 225.0 cm3, P < .001; CTV2 trung bình 174.4 cm3). Việc giảm thể tích não bị chiếu xạ gợi ý tiềm năng giảm độc tính thần kinh do xạ trị.
Mô hình tái phát: Tỷ lệ tái phát khối u trong, ngoài hoặc đa trung tâm so với thể tích mục tiêu chiếu xạ là tương đương giữa hai nhóm, chỉ ra không có nguy cơ tăng tái phát biên hoặc ngoài vùng chiếu xạ với CTV nhỏ hơn được hướng dẫn bằng hình ảnh tiên tiến.
An toàn: Các tác dụng phụ cấp 3 hoặc 4 liên quan đến điều trị xảy ra ở 5.3% bệnh nhân trong nhóm thử nghiệm và 3.8% trong nhóm tiêu chuẩn (P = .72), cho thấy khả năng chịu đựng tương đương.
Bình luận chuyên gia
Thử nghiệm này đại diện cho một bước tiến đáng kể hướng tới xạ trị cá nhân hóa trong HGG. Việc tích hợp MRI đa chế độ và tractography mô trắng để xác định mục tiêu cải thiện độ chính xác giải phẫu trong việc xác định các đường lây lan khối u tiềm năng, thách thức các khái niệm lề lối lớn truyền thống. Xạ trị tăng cường đồng thời giảm phân liều vừa phải (HSIB-IMRT) cung cấp tăng cường liều lượng có chọn lọc trong các vùng rủi ro cao của khối u, lý thuyết cải thiện kiểm soát khối u.
Mặc dù các điểm cuối chính PFS và OS không cho thấy sự khác biệt thống kê đáng kể, phương pháp thử nghiệm đạt được kết quả ung thư tương đương với thể tích chiếu xạ giảm đáng kể. Điều này có thể chuyển đổi thành lợi ích lâm sàng dài hạn có ý nghĩa bằng cách giảm thiểu suy giảm chức năng nhận thức và độc tính do xạ trị, đây là những mối quan tâm lớn đối với những người sống sót sau khối u não.
Hạn chế bao gồm việc thiết lập đơn trung tâm và kích thước mẫu tương đối nhỏ, có thể hạn chế khả năng tổng quát hóa. Cần các nghiên cứu đa trung tâm với các nhóm lớn hơn và thời gian theo dõi dài hơn để xác nhận các kết quả này và đánh giá các điểm cuối về chức năng nhận thức và chất lượng cuộc sống. Ngoài ra, các tiến bộ liên tục trong các dấu ấn hình ảnh có thể tinh chỉnh thêm việc xác định mục tiêu cá nhân hóa.
Kết luận
Xác định mục tiêu đã được điều chỉnh hướng dẫn bằng MRI đa chế độ và tractography mô trắng kết hợp với xạ trị tăng cường đồng thời giảm phân liều vừa phải (HSIB-IMRT) là một chiến lược hứa hẹn để điều trị ung thư não cấp cao mới được chẩn đoán. Bằng cách giảm đáng kể thể tích mục tiêu lâm sàng mà không làm giảm thời gian sống còn hoặc tăng nguy cơ tái phát, phương pháp này hỗ trợ việc chuyển hướng sang các giao thức xạ trị tiết kiệm thể tích cá nhân hóa hơn. Những đổi mới này có thể cuối cùng cải thiện kết quả chức năng dài hạn và chất lượng cuộc sống cho bệnh nhân mắc căn bệnh đáng sợ này.
Những kết quả này xứng đáng được tích hợp vào thiết kế của các thử nghiệm lâm sàng trong tương lai và được xem xét bởi các hướng dẫn xạ trị nhằm tối ưu hóa quản lý HGG.
Tài liệu tham khảo
- Stupp R, Mason WP, van den Bent MJ, et al. Xạ trị kết hợp với temozolomide đồng thời và bổ trợ cho glioblastoma. N Engl J Med. 2005;352(10):987-996. doi:10.1056/NEJMoa043330
- Weller M, van den Bent M, Tonn JC, et al. Hướng dẫn EANO về chẩn đoán và điều trị glioma khuếch tán ở người trưởng thành. Nat Rev Clin Oncol. 2021;18(3):170-186. doi:10.1038/s41571-020-00447-z
- Alexander BM, Ba S, Sampson JH, et al. Trường điện từ trong điều trị glioma ác tính: quá khứ, hiện tại và tương lai. Neuro Oncol. 2020;22(2):190-199. doi:10.1093/neuonc/noz161
- Yang W, Yan Q, Zhang A, et al. Xác định mục tiêu đã được điều chỉnh và xạ trị giảm phân liều vừa phải cho ung thư não cấp cao: Một thử nghiệm lâm sàng ngẫu nhiên. JAMA Netw Open. 2025;8(7):e2523053. doi:10.1001/jamanetworkopen.2025.23053