Bối cảnh
Liệu pháp miễn dịch khối u đã nổi lên như một bước tiến quan trọng trong điều trị ung thư, tận dụng cơ chế của hệ thống miễn dịch để nhắm mục tiêu vào tế bào ác tính với độ chính xác cao hơn. Tuy nhiên, vi môi trường khối u (TME) – được đặc trưng bởi các điều kiện sinh lý không đồng nhất bao gồm axit hóa, tiềm năng khử tăng cao và chuyển hóa năng lượng bất thường – đặt ra những rào cản đáng kể đối với giám sát và điều trị miễn dịch hiệu quả. Thách thức chính bao gồm sự trốn tránh miễn dịch do TME gây ra và các trạng thái chuyển hóa thay đổi như hiệu ứng Warburg trong tế bào khối u, làm giảm khả năng đáp ứng với điều trị.
Hơn nữa, đường dẫn truyền tín hiệu synthase chuỗi AMP-GMP vòng (cGAS)-kích thích gen interferon (STING) được công nhận là một cơ chế miễn dịch bẩm sinh quan trọng có khả năng khởi động miễn dịch chống khối u thông qua sản xuất interferon loại I và cytokine viêm. Mặc dù ion mangan (Mn2+) gần đây đã được xác định là chất kích hoạt mạnh của chuỗi tín hiệu cGAS-STING và hỗ trợ kích hoạt tế bào miễn dịch, hiệu quả lâm sàng của chúng bị hạn chế bởi phân phối không cụ thể và độc tính hệ thống tiềm ẩn.
Vì vậy, có nhu cầu cấp bách về các chiến lược cho phép giao hàng cụ thể của Mn2+, kết hợp với việc điều chỉnh chuyển hóa khối u và TME để tăng cường liệu pháp miễn dịch.
Thiết kế nghiên cứu
Nghiên cứu này giới thiệu nền tảng nano mới, LT@MnO@MON-HA (LMMH), được thiết kế để đáp ứng với vi môi trường khối u, cho phép giải phóng có kiểm soát của ion mangan (Mn2+) và chất ức chế glycolysis hướng tới ty thể lonidamine (LT). Phương pháp bao gồm:
– Tổng hợp hạt nano oxit mangan (MnO) được bao bọc trong vỏ silic mesoporous hữu cơ (MON) chứa liên kết disulfide cho phép phân hủy đáp ứng với glutathione (GSH).
– Bao bọc lonidamine hướng tới ty thể (LT) trong các lỗ mesoporous, sau đó phủ bề mặt bằng axit hyaluronic (HA) để nhắm mục tiêu cụ thể khối u thông qua sự gắn kết với thụ thể CD44.
– Đặc trưng vật lý hóa học toàn diện bao gồm hiển vi điện tử truyền dẫn, tán xạ ánh sáng động, đo điện thế zeta và các thử nghiệm in vitro đánh giá hoạt động xúc tác giống Fenton và giải phóng thuốc trong điều kiện mô phỏng TME.
– Đánh giá sự tạo ra ROS trong tế bào, can thiệp chuyển hóa vào glycolysis và đường pentose phosphate trong tế bào khối u 4T1.
– Kích hoạt đường dẫn truyền tín hiệu cGAS-STING được đánh giá trong tế bào thực bào gốc tuỷ xương qua phương pháp điện di Western, qRT-PCR và ELISA cytokine.
– Khám phá hiệu quả in vivo thông qua mô hình chuột mang khối u 4T1 hai bên với đánh giá chi tiết sự phát triển khối u, xâm nhập tế bào miễn dịch, hồ sơ cytokine và phân tích độc tính.
Phân tích thống kê bao gồm so sánh ANOVA và t-test, đảm bảo sự nghiêm ngặt trong diễn giải dữ liệu.
Kết quả chính
Đặc trưng nền tảng nano và đáp ứng với vi môi trường khối u
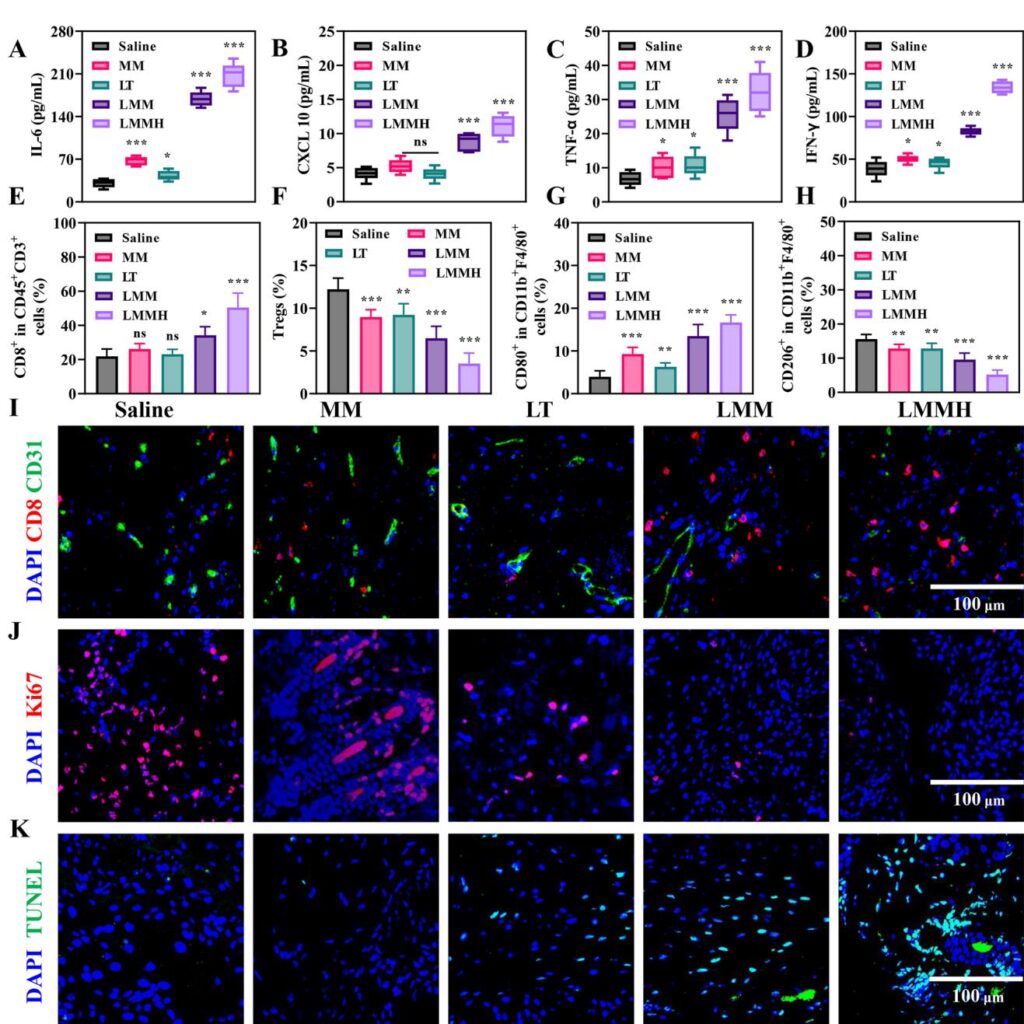
Nền tảng nano LMMH tổng hợp có cấu trúc lõi-vỏ rõ ràng với hạt nano MnO ở trung tâm được bảo vệ bởi vỏ silic mesoporous chứa liên kết disulfide đáp ứng GSH. Hình ảnh TEM và bản đồ phần tử xác nhận sự bao bọc mangan trong các ma trận silic. LMMH thể hiện sự ổn định colloid trong một tuần dưới điều kiện sinh lý và cho thấy sự giải phóng ion Mn2+ và LT được kích thích bởi axit và GSH, với lớp phủ HA cung cấp sự giải phóng kéo dài và khả năng nhắm mục tiêu khối u cao hơn. Trong môi trường in vitro, LMMH xúc tác chuyển đổi H2O2 nội sinh thành gốc tự do hydroxyl (·OH) cực kỳ phản ứng thông qua các phản ứng giống Fenton, cho phép liệu pháp hóa động học (CDT) hiệu quả. Đáng chú ý, LMMH tiêu thụ GSH hiệu quả trong điều kiện khử, làm tăng thêm stress oxi hóa trong tế bào khối u.
Can thiệp chuyển hóa và tăng cường sự tạo ra ROS
LT được bao bọc trong LMMH nhắm mục tiêu vào ty thể để rối loạn glycolysis và đường pentose phosphate của khối u, được chứng minh bằng mức glucose-6-phosphate và lactate giảm, và tỷ lệ NADP+/NADPH tăng trong tế bào 4T1 được xử lý. Sự can thiệp chuyển hóa này tăng cường mức ROS trong tế bào và cộng hưởng với sự tạo ra ·OH do Mn2+ xúc tác, dẫn đến tăng cường apoptosis tế bào khối u thông qua cơ chế stress oxi hóa. Những hiệu ứng này vượt trội hơn so với LT tự do hoặc các dạng MnO đơn lẻ, nhấn mạnh sự cải thiện giao hàng thuốc và hoạt động sinh học của nano-hóa.
Kích hoạt mạnh mẽ đường dẫn truyền tín hiệu cGAS-STING và cái chết tế bào miễn dịch (ICD)
LMMH kích hoạt hiệu quả đường dẫn truyền tín hiệu cGAS-STING trong tế bào thực bào, được chứng minh bằng sự tăng phosphoryl hóa của STING và IRF3, và biểu hiện và tiết cytokine interferon loại I (IFN-β), cytokine viêm (IL-6, TNF-α), và chemokine (CXCL10, CCL5) tăng cao. Sự kích hoạt miễn dịch này gây ra các dấu hiệu mạnh mẽ của cái chết tế bào miễn dịch trong tế bào khối u, bao gồm sự tiếp xúc bề mặt calreticulin tăng, sự giải phóng HMGB1, và tiết ATP, thúc đẩy việc trình bày kháng nguyên và kích thích miễn dịch thích ứng do tế bào T.
Hiệu quả điều trị in vivo và điều chỉnh miễn dịch
Trong mô hình ung thư vú 4T1 chuột hai bên, LMMH ức chế mạnh mẽ sự phát triển của khối u chính và xa với tỷ lệ ức chế khối u vượt quá 90%, vượt trội hơn so với LT tự do, MnO@MON (MM), hoặc các đối tác không kết hợp. Các khối u được xử lý bằng LMMH cho thấy sự xâm nhập tăng của tế bào T độc tế CD8+, sự phân cực M1 của đại thực bào tăng, và giảm tế bào T điều hòa và đại thực bào kiểu M2, cùng nhau tái tạo TME ức chế miễn dịch. Tương ứng, mức cytokine chống khối u IL-6, CXCL10, TNF-α, và IFN-γ trong khối u tăng đáng kể. Ngoài ra, hình ảnh miễn dịch cho thấy sự ức chế tập trung của quá trình tạo mạch máu và các dấu hiệu phân chia, cùng với sự apoptosis tế bào khối u tăng. Quan trọng, nền tảng nano thể hiện hồ sơ an toàn thuận lợi với không có độc tính hệ thống đáng kể hoặc tổn thương cơ quan được quan sát.
Bình luận chuyên gia
Nền tảng nano LMMH đại diện cho sự tích hợp tinh tế của công nghệ nano, miễn dịch học và điều chỉnh chuyển hóa khối u. Bằng cách kết hợp can thiệp chuyển hóa ty thể với kích hoạt cGAS-STING dựa trên Mn2+ có hướng, chiến lược này vượt qua những rào cản quan trọng do TME thù địch gây ra. Vỏ silic đáp ứng GSH có vẻ có lợi trong việc điều chỉnh động học giải phóng và tăng cường stress oxi hóa. Cơ chế liệu pháp kép này – can thiệp chuyển hóa và kích thích miễn dịch bẩm sinh – có thể cộng hưởng để phá vỡ sự trốn tránh miễn dịch của khối u và tăng cường miễn dịch chống khối u hệ thống, bao gồm cả kiểm soát di căn xa.
Tuy nhiên, việc dịch chuyển sang sử dụng lâm sàng yêu cầu giải quyết độ phức tạp và khả năng mở rộng của việc tổng hợp nanovật liệu, dược động học và an toàn dài hạn. Sự phân bố sinh học và các tác dụng ngoài mục tiêu tiềm ẩn của các chất dựa trên Mn cần được làm rõ thêm. Hơn nữa, việc kết hợp LMMH với các chất ức chế điểm kiểm tra hoặc các chất điều chỉnh miễn dịch khác có thể được khám phá để tăng cường hiệu quả hơn nữa. Nghiên cứu tương lai nên xem xét các mô hình khối u đa dạng và môi trường miễn dịch để xác nhận tính phổ quát. Tổng thể, cách tiếp cận này hứa hẹn trong việc nâng cao liệu pháp miễn dịch-chuyển hóa kết hợp ung thư.
Kết luận
Nền tảng nano dựa trên Mn đáp ứng với vi môi trường khối u LT@MnO@MON-HA (LMMH) giao tiếp hiệu quả việc ức chế chuyển hóa thông qua nhắm mục tiêu ty thể và kích hoạt miễn dịch bẩm sinh thông qua kích hoạt đường dẫn truyền tín hiệu cGAS-STING. Chiến lược cơ chế kép này giúp liệu pháp hóa động học và miễn dịch cộng hưởng để ức chế mạnh mẽ sự phát triển và di căn khối u trong các mô hình tiền lâm sàng. Thiết kế này tận dụng các kích thích cụ thể của TME như axit hóa và tiềm năng khử để giải phóng hàng hóa chính xác, giảm thiểu độc tính hệ thống. Sự ức chế chuyển hóa tăng cường stress oxi hóa, làm tăng độ nhạy cảm của tế bào khối u đối với sự tiêu diệt miễn dịch, trong khi ion Mn2+ thúc đẩy sản xuất cytokine và kích hoạt tế bào miễn dịch. Nền tảng nano tiên tiến này cung cấp một hướng hứa hẹn cho liệu pháp miễn dịch kết hợp thế hệ tiếp theo, giải quyết các rào cản quan trọng do sự đa dạng của khối u và sự trốn tránh miễn dịch gây ra. Nỗ lực dịch chuyển lâm sàng nên tập trung vào việc tối ưu hóa quy trình tổng hợp và xác nhận an toàn trong các ngữ cảnh khối u đa dạng. Tổng thể, LMMH minh họa tiềm năng điều trị của việc tích hợp điều chỉnh chuyển hóa khối u với kích hoạt đường dẫn truyền tín hiệu miễn dịch bẩm sinh để cải thiện kết quả cho bệnh nhân ung thư.