Nhấn mạnh
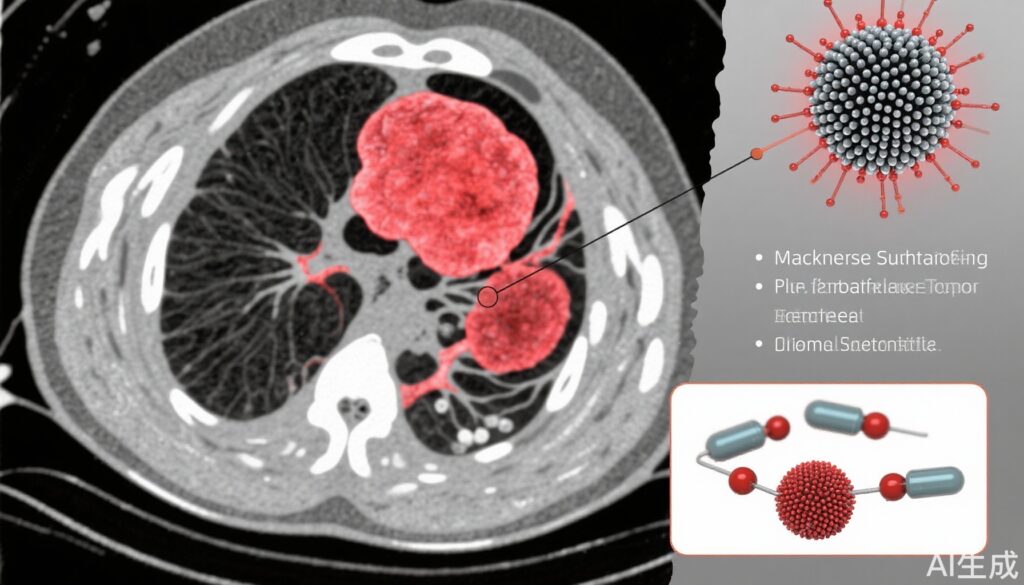
- Một nền tảng nano sulfua mangan (MS) được nạp với chất ức chế bơm proton (PPI) cho phép hình ảnh hóa MRI thời gian thực của axit hóa khối u.
- Nền tảng nano giải phóng Mn2+, H2S và PPI trong lysosome khối u có tính axit, gây ra axit hóa khối u và tăng cường độ tương phản MRI.
- Axit hóa khối u có mối tương quan tích cực với sự suy giảm khối u, cho phép dự đoán hiệu quả điều trị sớm hơn so với hình ảnh cấu trúc thông thường.
- Axit hóa khối u do nền tảng nano gây ra cũng bất ngờ ức chế di căn khối u, nổi bật tiềm năng lợi ích điều trị.
Nền tảng nghiên cứu và gánh nặng bệnh tật
Ung thư vẫn là nguyên nhân chính gây ra tỷ lệ mắc bệnh và tử vong trên toàn thế giới, với sự đa dạng của khối u đặt ra thách thức quan trọng đối với việc đánh giá kịp thời đáp ứng điều trị. Các phương pháp thông thường thường dựa vào việc đo các thay đổi giải phẫu hoặc thể tích khối u, đòi hỏi thời gian dài để biểu hiện. Sự chậm trễ này có thể dẫn đến mất cơ hội điều chỉnh phác đồ điều trị trước khi bệnh tiến triển. Ngoài ra, môi trường vi mô có tính axit của khối u là một đặc điểm đã được xác nhận liên quan đến sự tiến triển, xâm lấn và kháng điều trị. Bơm proton và chuyển hóa bất thường góp phần làm axit hóa ngoại bào, nhưng việc đánh giá không xâm lấn và thời gian thực của axit hóa khối u vẫn còn khó khăn về kỹ thuật. Do đó, có nhu cầu lâm sàng chưa được đáp ứng đối với các cách tiếp cận sáng tạo có thể tạo bản đồ động độ axit của khối u và cung cấp thông tin sớm về hiệu quả điều trị, cho phép điều chỉnh kịp thời và cá nhân hóa phác đồ điều trị.
Thiết kế nghiên cứu
Nghiên cứu này giới thiệu một nền tảng nano dựa trên sulfua mangan (MSP) được nạp với chất ức chế bơm proton (PPI) nhằm ứng dụng trong chẩn đoán và điều trị ung thư. Việc tổng hợp MSP được thực hiện qua phương pháp hóa học hai bước bao gồm muối acetylacetonat mangan và thioacetamide trong ethylene glycol, sản xuất ra các hạt nano sulfua mangan hình cầu có đường kính khoảng 120 nm. Các đặc tính vật lý hóa học của nền tảng nano bao gồm hình thái, tính tinh thể, hóa học bề mặt và sự phân hủy phụ thuộc pH được đặc trưng bằng kính hiển vi điện tử truyền qua (TEM), TEM phân giải cao, nhiễu xạ tia X (XRD) và quang phổ điện tử tia X (XPS).
Các thành phần chức năng được giải phóng bởi MSP—Mn2+, H2S và PPI—được định lượng dưới các điều kiện pH khác nhau để mô phỏng môi trường axit của lysosome khối u. Việc xác minh sự hình thành H2S được thực hiện bằng các bài kiểm tra kết tủa AgNO3, và sự sản xuất các loài oxy phản ứng thông qua phản ứng Fenton giống như Mn2+ được đánh giá bằng các bài kiểm tra màu. Đo lường độ nhạy MRI (r1) được thực hiện để xác định sự tăng cường tín hiệu MRI phụ thuộc pH do MSP.
Nền tảng nano được đánh giá thêm in vitro để điều chỉnh axit hóa khối u bằng cách thay đổi tỷ lệ tải PPI (10%, 25%, 44%) và đánh giá tác động kết quả lên pH lysosome khối u, chuyển hóa glucose và sản xuất lactate. Mối tương quan giữa axit hóa khối u gây ra, sự phân hủy nền tảng nano và cường độ tín hiệu MRI được phân tích hệ thống. Ngoài ra, tác động của axit hóa khối u đối với sự suy giảm khối u và khả năng di căn được điều tra.
Kết quả chính
Các hạt nano sulfua mangan được tổng hợp có hình thái hình cầu đồng đều với độ tinh thể cao phù hợp với các mặt phẳng MnS (002). XPS xác nhận sự hiện diện của Mn2+ và ion sulfide, hỗ trợ việc tổng hợp thành công. Các nghiên cứu phân hủy do axit cho thấy sự phân hủy MSP tăng lên ở pH thấp (pH 4.5) với hiệu suất tối đa (79.5%), giải phóng Mn2+, PPI và H2S. Sự phân hủy này đi kèm với sự hình thành bong bóng nhìn thấy được và mùi H2S đặc trưng, và kết tủa Ag2S màu đen xác nhận sự hình thành H2S.
Mn2+ giải phóng xúc tác sự sản xuất gốc hydroxyl (•OH) thông qua các phản ứng Fenton giống, được xác nhận bằng các bài kiểm tra màu, chỉ ra tác dụng độc tế bào tiềm năng đóng góp vào hoạt động chống khối u. Quan trọng hơn, độ nhạy MRI (r1) được tăng cường đáng kể trong điều kiện axit, cho thấy sự tăng cường tín hiệu MRI T1 rõ ràng phụ thuộc pH và liều lượng, với độ nhạy cao nhất ở pH 4.5 (8.243 mM−1 s−1) và thấp nhất ở pH trung tính (1.628 mM−1 s−1).
Các nền tảng nano với tỷ lệ tải PPI khác nhau thành công trong việc gây ra axit hóa khối u theo cấp độ bằng cách ức chế bơm V-ATPase và tăng nồng độ H+ trong tế bào. H2S giải phóng tăng cường tiêu thụ glucose của khối u, tạo ra axit lactic nhiều hơn và củng cố axit hóa, từ đó tăng tốc sự phân hủy MSP và tăng cường tín hiệu MRI trong một vòng phản hồi tích cực. Đặc biệt, mức độ axit hóa khối u có mối tương quan tích cực với các chỉ số suy giảm khối u, cho phép dự đoán hiệu quả điều trị thời gian thực trước khi có những thay đổi cấu trúc thông thường.
Bất ngờ, sự tăng axit hóa khối u cũng ức chế sự phân tán di căn, cung cấp lợi ích điều trị bổ sung. Do đó, nền tảng nano kết nối chẩn đoán và điều trị bằng cách theo dõi đồng thời độ axit môi trường vi mô của khối u và điều chỉnh sinh lý khối u.
Bình luận chuyên gia
Nền tảng nano sulfua mangan sáng tạo này đại diện cho một bước tiến đáng kể trong lĩnh vực hình ảnh hóa môi trường vi mô khối u và theo dõi điều trị. Khả năng hình ảnh hóa MRI thời gian thực, không xâm lấn của axit hóa khối u cung cấp cho các bác sĩ một dấu ấn sinh học động phản ánh trạng thái chuyển hóa của khối u và đáp ứng với điều trị sớm hơn so với các tiêu chí dựa trên kích thước truyền thống.
Từ góc độ cơ chế, tận dụng sự axit hóa lysosome khối u để kích thích giải phóng hợp chất và gây ra một vòng phản hồi chuyển hóa là ví dụ điển hình về thiết kế y học nano chính xác. Ngoài ra, khả năng của H2S trong việc tái tạo chuyển hóa khối u và hoạt động Fenton giống của Mn2+ để tạo ra các gốc tự do độc tế bào cung cấp các tác dụng điều trị đa phương thức vốn có của nền tảng nano.
Các hạn chế bao gồm cần phải xác minh toàn diện in vivo, đánh giá an toàn dài hạn và đánh giá trên các mô hình khối u đa dạng để xác nhận tính tổng quát. Hơn nữa, việc dịch chuyển vào thực hành lâm sàng sẽ yêu cầu mở rộng quy mô tổng hợp và điều hướng con đường quy định. Tuy nhiên, việc tích hợp độ tương phản MRI phản ứng pH và giải phóng điều trị trong một cấu trúc nano đơn có thể biến đổi theo dõi điều trị ung thư thời gian thực và các chiến lược điều trị thích ứng.
Kết luận
Nền tảng nano sulfua mangan được nạp với chất ức chế bơm proton cung cấp một công cụ chẩn đoán và điều trị mới cho phép hình ảnh hóa MRI thời gian thực của axit hóa khối u. Bằng cách tận dụng sự axit hóa lysosome khối u để giải phóng các tác nhân điều trị và tăng cường tín hiệu MRI, nền tảng này cung cấp dự đoán sớm về hiệu quả điều trị, có thể cho phép các bác sĩ điều chỉnh can thiệp một cách linh hoạt. Mối tương quan tích cực giữa axit hóa khối u được đo bằng MRI và sự suy giảm khối u nhấn mạnh tính hữu ích lâm sàng của cách tiếp cận này. Ngoài ra, sự ức chế di căn quan sát được nổi bật tiềm năng điều trị bổ sung. Dịch chuyển lâm sàng trong tương lai có thể tối ưu hóa quản lý ung thư bằng cách tích hợp phản hồi chẩn đoán kịp thời với điều chỉnh chuyển hóa mục tiêu.
Tham khảo
1. Gillies RJ, Robey I, Gatenby RA. Nguyên nhân và hậu quả của tăng chuyển hóa glucose trong các khối u. J Nucl Med. 2008;49 Suppl 2:24S-42S.
2. Webb BA, Chimenti M, Jacobson MP, Barber DL. Sự mất kiểm soát pH: một cơn bão hoàn hảo cho sự tiến triển khối u. Nat Rev Cancer. 2011;11(9):671-677.
3. Li W, Fan W, Bu W, et al. Nano tác nhân oxit mangan thông minh cho liệu pháp quang nhiệt hướng dẫn bằng hình ảnh cộng hưởng từ. Chem Sci. 2017;8(3):1193-1200.
4. Neri D, Supuran CT. Can thiệp vào việc điều hòa pH trong khối u như một chiến lược điều trị. Nat Rev Drug Discov. 2011;10(10):767-777.
5. Chen Z, Zhao P, Luo Z, et al. Nền tảng nano polyme chứa liên kết disulfide nhạy cảm với glutathione cho chẩn đoán và điều trị đồng thời khối u. Biomaterials. 2015;73:149-162.
6. DeBerardinis RJ, Chandel NS. Cơ sở của chuyển hóa ung thư. Sci Adv. 2016;2(5):e1600200.
7. Murphy MP. Nhắm mục tiêu các cation lipophilic vào ty thể. Biochim Biophys Acta. 2008;1777(7-8):1028-1031.
8. Chen H, Zeng X, Ma Y, et al. Nhắm mục tiêu sự thiếu oxy và các loài oxy phản ứng của khối u để điều trị quang động hiệu quả. Chem Soc Rev. 2021;50(20):11933-11955.