Những Điểm Nổi bật
- Anrikefon, một chất kích thích thụ thể opioid kappa chọn lọc và hạn chế ngoại vi, giảm đáng kể cường độ ngứa trong ngứa liên quan đến bệnh thận mạn tính (CKD) ở bệnh nhân thẩm tách máu.
- 37% bệnh nhân được điều trị bằng anrikefon đạt ít nhất giảm 4 điểm trên thang đo WI-NRS sau 12 tuần, so với 15% trong nhóm giả dược (P<0.001).
- Cải thiện chất lượng cuộc sống liên quan đến ngứa được chứng minh qua việc giảm đáng kể các thang đo 5-D ngứa và Skindex-10, kéo dài qua 40 tuần trong giai đoạn mở rộng.
- Hồ sơ an toàn có lợi, với chóng mặt nhẹ đến vừa là tác dụng phụ chính, không có di chứng lâm sàng.
Nền tảng
Ngứa liên quan đến bệnh thận mạn tính (CKD-aP) là triệu chứng phổ biến, gây khó chịu ở bệnh nhân thẩm tách máu, ảnh hưởng tới khoảng 40% dân số này. CKD-aP làm suy giảm đáng kể chất lượng cuộc sống, giấc ngủ và sức khỏe tổng thể, và đã được liên kết với tăng tỷ lệ mắc và tử vong. Dù có tác động lâm sàng, các lựa chọn điều trị vẫn còn hạn chế và thường không hài lòng.
Chất kích thích thụ thể opioid kappa (KOR) đã nổi lên như một lớp thuốc hứa hẹn nhờ khả năng điều chỉnh tín hiệu thần kinh cảm giác liên quan đến ngứa. Tuy nhiên, KOR kích thích trung ương có thể gây ra các tác dụng không mong muốn đối với hệ thống thần kinh trung ương. Anrikefon (trước đây là HSK21542) là một chất kích thích KOR chọn lọc và hạn chế ngoại vi mới, được thiết kế để giảm cường độ ngứa mà không xâm nhập vào hệ thống thần kinh trung ương, do đó có thể tối thiểu hóa các tác dụng phụ đối với hệ thống thần kinh trung ương.
Nội dung Chính
Thiết kế Nghiên cứu và Đối tượng
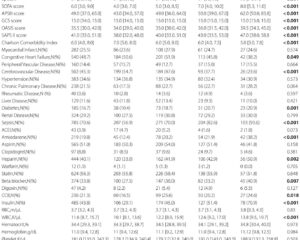
Từ tháng 6 năm 2022 đến tháng 6 năm 2024, một thử nghiệm ngẫu nhiên kiểm soát giả dược đa trung tâm, mù đôi giai đoạn 3 đã được tiến hành tại 50 trung tâm ở Trung Quốc, tuyển chọn bệnh nhân thẩm tách máu trưởng thành mắc ngứa liên quan đến bệnh thận mạn tính mức độ trung bình đến nặng. Tổng cộng 652 bệnh nhân được sàng lọc, và 545 bệnh nhân được phân ngẫu nhiên 1:1 để nhận anrikefon tiêm tĩnh mạch (0.3 µg/kg) hoặc giả dược ba lần mỗi tuần trong 12 tuần, tiếp theo là giai đoạn mở rộng tự nguyện 40 tuần với anrikefon.
Kết Quả Chính và Phụ
Điểm cuối chính là tỷ lệ bệnh nhân đạt giảm ít nhất 4 điểm trên thang đo trung bình hàng tuần 24 giờ Cường độ Ngứa Nặng nhất (WI-NRS) tại tuần 12 so với cơ bản. Điểm cuối phụ bao gồm tỷ lệ đạt giảm ít nhất 3 điểm trên thang đo WI-NRS và cải thiện chất lượng cuộc sống liên quan đến ngứa được đánh giá bằng thang đo Skindex-10 và 5-D ngứa. Kết quả an toàn bao gồm tỷ lệ và mức độ nghiêm trọng của các sự cố bất lợi trong suốt quá trình điều trị.
Kết Quả Hiệu quả
Trong số 275 bệnh nhân được điều trị bằng anrikefon, 37% đạt điểm cuối chính so với 15% trong nhóm giả dược (P<0.001). Đối với điểm cuối phụ (giảm ít nhất 3 điểm trên thang đo WI-NRS), 51% là người đáp ứng trong nhóm anrikefon so với 24% trong nhóm giả dược (P<0.001). Người dùng anrikefon cũng thể hiện giảm đáng kể trung bình trên thang đo 5-D ngứa (-5.3 so với -3.1, P<0.001) và điểm Skindex-10 (-15.2 so với -9.3, P<0.001), cho thấy cải thiện đáng kể về chất lượng cuộc sống liên quan đến ngứa.
Các cải thiện bền vững được xác nhận trong giai đoạn mở rộng 40 tuần, với lợi ích chất lượng cuộc sống liên tục sử dụng thang đo 5-D ngứa.
Hồ sơ An toàn
Phân tích an toàn cho thấy anrikefon nói chung được dung nạp tốt. Chóng mặt nhẹ đến vừa xảy ra nhiều hơn trong nhóm anrikefon so với giả dược nhưng không có hậu quả lâm sàng lớn. Các sự cố bất lợi khác tương tự giữa các nhóm, và không có tác dụng phụ đáng kể liên quan đến hệ thống thần kinh trung ương được báo cáo, phù hợp với sự hạn chế ngoại vi của thuốc.
Bình luận Chuyên gia
Thử nghiệm giai đoạn 3 quan trọng này cung cấp bằng chứng mạnh mẽ ủng hộ anrikefon là một phương pháp điều trị hiệu quả và an toàn cho ngứa liên quan đến bệnh thận mạn tính mức độ trung bình đến nặng ở bệnh nhân thẩm tách máu—một lĩnh vực có nhu cầu lâm sàng chưa được đáp ứng đáng kể. Sự chọn lọc ngoại vi của anrikefon tránh được các tác dụng phụ liên quan đến hệ thống thần kinh trung ương đã hạn chế việc sử dụng các KOR kích thích khác, làm cho nó trở thành một chất liệu điều trị hứa hẹn.
Mức độ giảm cường độ ngứa (ít nhất 4 điểm ở 37% bệnh nhân) đạt ngưỡng có ý nghĩa lâm sàng và được hỗ trợ bởi những cải thiện song song trên các thang đo chất lượng cuộc sống được xác thực. Dữ liệu dài hạn từ giai đoạn mở rộng là khích lệ, cho thấy lợi ích bền vững mà không có lo ngại an toàn tiến triển.
Tuy nhiên, mặc dù có ý nghĩa thống kê, ít hơn một nửa số bệnh nhân đạt điểm cuối chính, làm nổi bật những thách thức còn lại trong quản lý CKD-aP và sự dị biệt của phản ứng của bệnh nhân. Các nghiên cứu tiếp theo khám phá các liệu pháp kết hợp, các dấu sinh học dự đoán phản ứng và so sánh trực tiếp với các chất chống ngứa khác sẽ có giá trị.
Thiết kế đa trung tâm lớn và ngẫu nhiên mù đôi nghiêm ngặt của nghiên cứu mang lại độ tin cậy và khả năng áp dụng cao trong các dân số thẩm tách máu thực tế, đặc biệt là trong các nhóm dân tộc châu Á, mặc dù việc áp dụng cho các nhóm dân tộc khác cần được đánh giá thêm.
Kết luận
Anrikefon đại diện cho một bước tiến đáng kể trong quản lý ngứa liên quan đến bệnh thận mạn tính ở bệnh nhân thẩm tách máu, cung cấp một phương pháp điều trị hiệu quả, dễ dung nạp, cải thiện cả gánh nặng triệu chứng và chất lượng cuộc sống. Đợi phê duyệt quy định, anrikefon có thể lấp đầy một khoảng trống điều trị đáng kể, cải thiện kết quả bệnh nhân trong dân số khó điều trị này. Nghiên cứu trong tương lai nên tập trung vào xác thực dân số rộng hơn, an toàn dài hạn và tích hợp vào hướng dẫn lâm sàng CKD-aP.
Tài liệu tham khảo
- Liu BC, Li ZL, Zhang P, Zhong AM, Bai YL, Xu Y, Gao BH, Li YL, Wang Y, Zhou LH, Yao L, Wang JX, Yan R, Wang L, Liao B, Xie DQ, Yi XM, Guan TJ, Wang CL, Li GS, Li FQ, Chen JH; Nhóm hợp tác Anrikefon-302. Hiệu quả và an toàn của anrikefon ở bệnh nhân thẩm tách máu có ngứa: Thử nghiệm ngẫu nhiên kiểm soát giả dược đa trung tâm giai đoạn 3. BMJ. 2025 Aug 19;390:e085208. doi:10.1136/bmj-2025-085208. PMID: 40829896.