Nền tảng nghiên cứu và gánh nặng bệnh tật
Irinotecan là một tác nhân hóa trị được sử dụng rộng rãi trong điều trị ung thư đại trực tràng (CRC); tuy nhiên, tiêu chảy muộn vẫn là một tác dụng phụ đáng kể và khó quản lý, thường xuyên hạn chế hiệu quả lâm sàng của nó. Theo truyền thống, độc tính đường ruột từ irinotecan đã được quy cho các enzym β-glucuronidase (β-GUS) của vi khuẩn, hoạt hóa lại chất chuyển hóa độc hại SN-38 trong lòng ruột. Mặc dù có hiểu biết này, các chất ức chế β-GUS chỉ mang lại lợi ích lâm sàng hạn chế, cho thấy có các cơ chế khác đóng góp vào tổn thương ruột do irinotecan. Việc xác định các cơ chế và dấu sinh học như vậy là quan trọng để cải thiện kết quả của bệnh nhân và cá nhân hóa các phương pháp điều trị trong quản lý CRC.
Thiết kế nghiên cứu
Nghiên cứu đa phương diện này phân tích toàn diện hệ vi sinh vật đường ruột và các chất chuyển hóa ở bệnh nhân CRC được điều trị bằng irinotecan, chia thành các nhóm có hoặc không có tiêu chảy. Phân tích gen 16S rRNA độ phân giải cao, metagenomics bắn phá và metabolomics đã đặc trưng hóa cộng đồng vi sinh vật và hồ sơ chuyển hóa. Việc cấy ghép vi sinh vật phân tươi ban đầu vào chuột không vi khuẩn đánh giá khả năng truyền nhiễm của sự nhạy cảm với độc tính của irinotecan. Các đóng góp của các loại vi khuẩn và chất chuyển hóa cụ thể được kiểm tra bằng kỹ thuật sinh học chuyển hóa và nuôi cấy tế bào tổ chức ruột. Thám cứu cơ chế bao gồm phân tích biểu hiện gen để điều tra tác động lên tế bào gốc ruột và can thiệp hóa học để đánh giá các con đường tín hiệu bị ảnh hưởng bởi các chất chuyển hóa vi khuẩn.
Kết quả chính
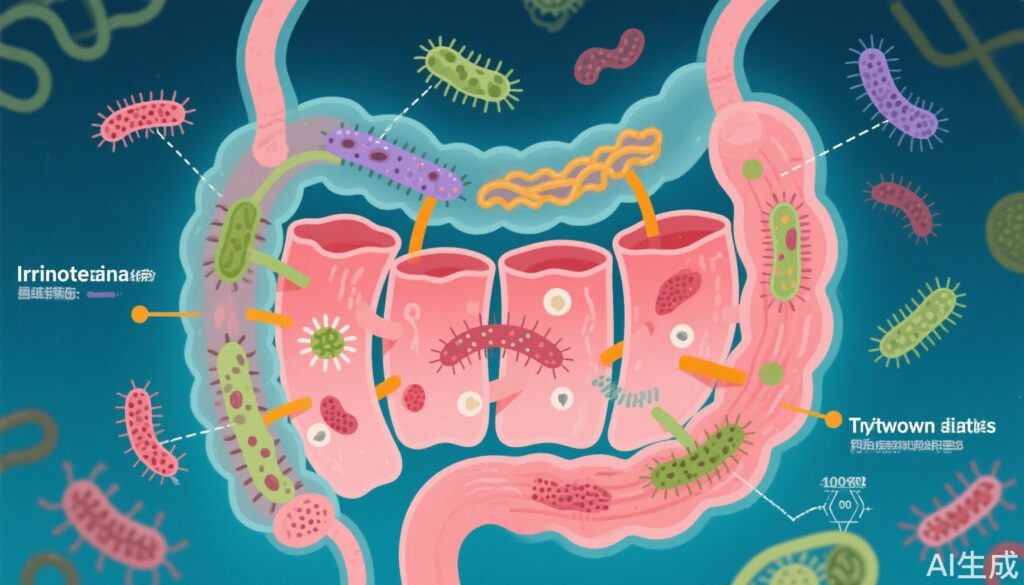
Phân tích cộng đồng vi khuẩn cho thấy sự tái cấu trúc vi sinh vật đường ruột đặc biệt ở bệnh nhân có nguy cơ tiêu chảy so với những người không có tiêu chảy trong quá trình điều trị irinotecan. Đặc biệt, Bacteroides intestinalis được làm giàu đáng kể trong các nhóm có tiêu chảy và ở chuột được điều trị bằng irinotecan, gợi ý về vai trò gây bệnh của nó. Việc cấy ghép vi sinh vật phân (FMT) từ bệnh nhân có tiêu chảy đã tăng cường sự nhạy cảm của chuột nhận với irinotecan, thiết lập mối quan hệ nhân quả.
Các thí nghiệm tiếp theo đã chứng minh rằng sự xâm nhập của B. intestinalis làm tăng độ nhạy cảm của tế bào biểu mô ruột đối với tổn thương hóa học do irinotecan gây ra. Hiệu ứng này phần lớn được trung gian thông qua việc tăng sản xuất chất chuyển hóa indole-3-acetate (IAA) từ tryptophan. Cả B. intestinalis và vi khuẩn được chỉnh sửa gen để tăng tổng hợp IAA đều làm nặng thêm tổn thương biểu mô trong các mô hình chuột.
Một cách cơ chế, IAA được tìm thấy ức chế con đường tín hiệu phosphoinositide 3-kinase (PI3K)-Akt, quan trọng cho sự tái tạo và tái sinh của tế bào biểu mô ruột. Sự ức chế con đường này dẫn đến khả năng sửa chữa biểu mô suy yếu trong quá trình tổn thương do irinotecan gây ra, do đó làm tăng độc tính ruột.
Lâm sàng, mức độ IAA trong phân có mối tương quan dương với mức độ nghiêm trọng của tiêu chảy ở bệnh nhân CRC đang điều trị bằng irinotecan, nổi bật tiềm năng của nó như một dấu sinh học dự đoán độc tính ruột do irinotecan gây ra.
Bình luận chuyên gia
Nghiên cứu này thách thức quan điểm phổ biến rằng các enzym β-glucuronidase của vi khuẩn là nguyên nhân duy nhất gây tiêu chảy muộn do irinotecan bằng cách xác định các chất chuyển hóa vi khuẩn nội sinh, đặc biệt là IAA, là các điều chỉnh quan trọng của độc tính. Cách tiếp cận tích hợp kết hợp phân loại hệ vi sinh vật, metabolomics và nghiên cứu cơ chế cung cấp bằng chứng thuyết phục về cách sự mở rộng của B. intestinalis điều chỉnh sự nhạy cảm của chủ qua các tác động chuyển hóa.
Những phát hiện này mở ra các hướng tiếp cận điều trị mới nhắm mục tiêu vào các con đường chuyển hóa vi khuẩn thay vì chỉ ức chế enzym. Các chiến lược can thiệp có thể bao gồm điều chỉnh chuyển hóa tryptophan, giảm chọn lọc B. intestinalis, hoặc phục hồi con đường tín hiệu PI3K-Akt để thúc đẩy sự sửa chữa biểu mô.
Tuy nhiên, cần phải xác minh thêm lâm sàng IAA trong phân như một dấu sinh học dự đoán, cùng với các nghiên cứu về các tương tác tiềm năng với các loài vi khuẩn và chất chuyển hóa khác. Ngoài ra, mặc dù các mô hình chuột và nuôi cấy tổ chức cung cấp khả năng sinh học, sự biến đổi trong hệ vi sinh vật và đáp ứng của chủ ở người nhấn mạnh nhu cầu về các phương pháp cá nhân hóa trong dịch vụ lâm sàng.
Kết luận
Việc làm rõ sự điều chỉnh độc tính ruột do irinotecan thông qua indole-3-acetate từ tryptophan của Bacteroides intestinalis đại diện cho một sự thay đổi trong cách hiểu về tiêu chảy do hóa trị gây ra. Cơ chế mới này nổi bật sự tương tác phức tạp giữa các chất chuyển hóa từ vi khuẩn đường ruột và sự kiên cường của ruột chủ.
Việc xác định IAA như một dấu sinh học dự đoán có thể cho phép phân loại trước các bệnh nhân có nguy cơ mắc độc tính nghiêm trọng, cho phép các phác đồ hóa trị cá nhân hóa và can thiệp nhắm mục tiêu vào hệ vi sinh vật để cải thiện khả năng chịu đựng. Quan trọng hơn, những phát hiện này báo hiệu một nhu cầu rộng lớn hơn để xem xét các chất chuyển hóa vi khuẩn nội sinh trong sự thay đổi phản ứng thuốc và sự dễ bị tổn thương của các sự cố bất lợi trong điều trị ung thư và hơn thế nữa.
Tài liệu tham khảo
Hou Y, Wu H, Zhang Z, Wang J, Chen Q, Lian C, He D, Li Z, Wei W, Lin X, Sun D, Cao B, Xu T, Cai M, Wang G, Zhang X, Duan L, Hao H, Zheng X. Bacteroides intestinalis mediates the sensitivity to irinotecan toxicity via tryptophan catabolites. Gut. 2025 Sep 2:gutjnl-2024-334699. doi:10.1136/gutjnl-2024-334699. Epub ahead of print. PMID: 40903035.
Văn献附加:
Stringer AM, Gibson RJ, Logan RM, et al. Irinotecan-induced mucositis is associated with changes in intestinal mucins, bacterial translocation, and activation of inflammation in the gut. Cancer Chemother Pharmacol. 2009;64(2):277–284. doi:10.1007/s00280-008-0820-2
Dresser MJ, Bailey DG, Leake BF, Schwarz UI, Dawson PA, Freeman DJ. Effects of intestinal microflora on drug metabolism: evaluation in germ-free and conventional rats. Life Sci. 2002;70(2):287–299. doi:10.1016/s0024-3205(01)01450-1
Smith CJ, Fratamico PM, Gunther NW. The role of bacterial β-glucuronidase in the toxicity of irinotecan. Drug Metab Rev. 2023;55(1):142-158. doi:10.1080/03602532.2022.2099385