Tóm tắt
– Sự kích hoạt bất thường của con đường tín hiệu Hippo/YAP là yếu tố quan trọng trong sự phát triển của ung thư gan tế bào (HCC).
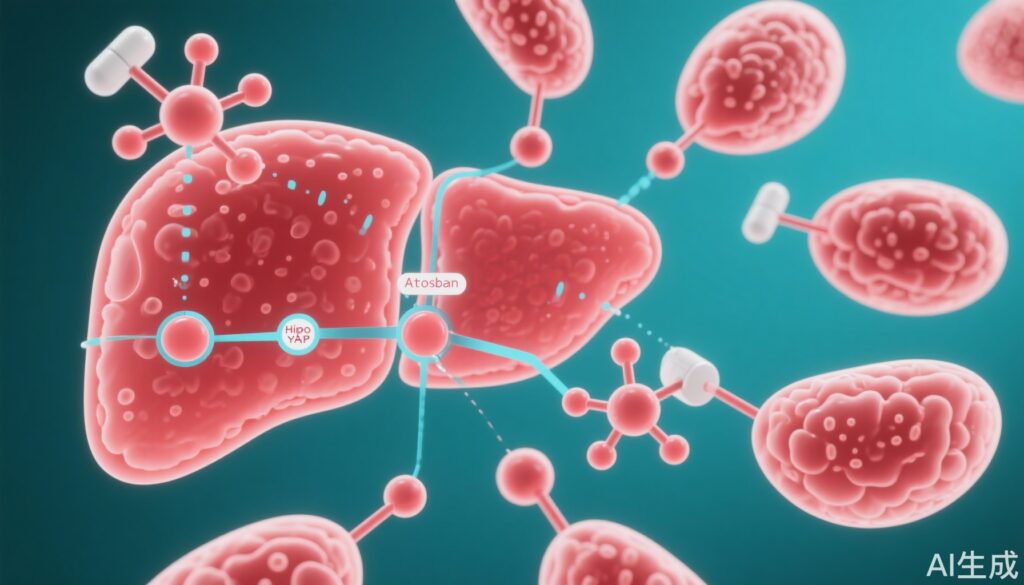
– Thụ thể oxytocin (OXTR), một thụ thể liên kết với protein G, kích hoạt tín hiệu Hippo/YAP thông qua Gq/11 và tạo ra một vòng phản hồi tích cực thúc đẩy sự tiến triển của ung thư gan.
– Atosiban, một chất đối kháng OXTR và là thuốc tocolytic đã được công nhận, hiệu quả trong việc phá vỡ vòng phản hồi tích cực này, ức chế sự tăng trưởng khối u trong nhiều mô hình tiền lâm sàng HCC.
– Phát hiện này mở ra hướng tái sử dụng Atosiban và nhấn mạnh OXTR là mục tiêu điều trị hứa hẹn trong HCC, đáp ứng nhu cầu lâm sàng cấp bách về các chiến lược điều trị hiệu quả.
Nền tảng nghiên cứu và gánh nặng bệnh tật
Ung thư gan tế bào (HCC) là dạng ung thư gan nguyên phát phổ biến nhất trên toàn cầu, xếp hạng là nguyên nhân hàng đầu gây tử vong do ung thư. Mặc dù có những tiến bộ, tiên lượng vẫn kém, đặc biệt ở giai đoạn muộn do thiếu các lựa chọn điều trị hiệu quả. Từ góc độ phân tử, sự kích hoạt bất thường của con đường tín hiệu Hippo, tác nhân Yes-associated protein (YAP), đóng vai trò quan trọng trong sự phát sinh của HCC, thúc đẩy các chương trình biểu hiện gen gây ung thư và sự tiến triển của khối u.
Các nỗ lực để ức chế trực tiếp YAP đã gặp phải thất bại: đáng chú ý, verteporfin, một chất ức chế YAP, không chứng minh được hiệu quả trong các thử nghiệm lâm sàng có thể do sự không ổn định của thuốc và độc tính ngoại mục tiêu. Do đó, trọng tâm nghiên cứu đã chuyển sang các điều chỉnh viên thượng nguồn như các thụ thể liên kết với protein G (GPCRs), điều chỉnh tín hiệu Hippo/YAP. Với sự đa dạng lớn của GPCRs và các đối tác protein G khác nhau, việc xác định thụ thể chính thúc đẩy HCC vẫn là thách thức.
Thiết kế nghiên cứu
Một nhóm nghiên cứu Trung Quốc từ Đại học Y Dược Trung Quốc, Đại học Y Dược Trung Quốc Hà Nam và Đại học Sơn Đông đã tiến hành sàng lọc rộng rãi các thuốc được FDA phê duyệt nhắm vào GPCRs để xác định các ứng cử viên ảnh hưởng đến hoạt động Hippo/YAP. Họ sử dụng phương pháp tiếp cận tổng hợp bao gồm phân tích phong phú tập gen (GSEA) để liên kết biểu hiện GPCR với kích hoạt con đường tín hiệu Hippo/YAP, sau đó là màn hình chức năng siRNA trong các dòng tế bào ung thư gan và đối chiếu với 134 thuốc GPCR được FDA phê duyệt.
Thụ thể oxytocin (OXTR) nổi lên là ứng cử viên hàng đầu. Các nhà nghiên cứu sau đó đánh giá mức độ biểu hiện OXTR trong HCC so với gan bình thường và đánh giá mối tương quan lâm sàng với kết quả của bệnh nhân. Các nghiên cứu chức năng bao gồm việc giảm hoặc tăng biểu hiện OXTR in vitro và in vivo sử dụng nhiều mô hình chuột HCC: u dưới da và u đồng vị, các tổ chức gốc từ bệnh nhân, và chuột biến đổi gen MST1/2 double knockout. Các nghiên cứu cơ chế khám phá sự tương tác giữa OXTR và protein Gq/11, các con đường Rho/ROCK phía sau, hoạt động của kinase LATS1 và trạng thái phosphoryl hóa của YAP. Các xét nghiệm immunoprecipitation chromatin (ChIP) làm sáng tỏ quy luật phản hồi giữa YAP và biểu hiện gen OXTR. Cuối cùng, tác động của Atosiban, một chất đối kháng OXTR được chấp thuận để điều trị sinh non sớm, đối với sự tăng trưởng khối u và tín hiệu đã được đánh giá trong các mô hình này.
Kết quả chính
Xác định OXTR là GPCR điều chỉnh chính trong HCC
Biểu hiện OXTR được tăng đáng kể ở cả mức mRNA và protein trong các mô HCC so với gan bình thường. Biểu hiện OXTR cao có mối tương quan mạnh mẽ với tiên lượng sống và tiên lượng xấu hơn ở bệnh nhân HCC. Sự im lặng chức năng của OXTR ức chế sự tăng sinh tế bào HCC và giảm khối lượng khối u trong các mô hình chuột, trong khi tăng biểu hiện OXTR có tác dụng ngược lại, xác nhận vai trò thúc đẩy khối u của nó.
Các hiểu biết cơ chế: Kích hoạt trục OXTR-Gq/11-Hippo/YAP
OXTR kích hoạt con đường tín hiệu Hippo/YAP thông qua sự liên kết với tiểu đơn vị Gq/11, sau đó kích thích chuỗi tín hiệu Rho/ROCK. Sự kích hoạt này dẫn đến ức chế kinase LATS1, thành phần cốt lõi của con đường tín hiệu Hippo chịu trách nhiệm cho phosphorylization của YAP. Giảm hoạt động của LATS1 dẫn đến mất phosphorylization và tích tụ hạt nhân của YAP, tạo thành các phức hợp biểu hiện gen TEAD hoạt động thúc đẩy sự biểu hiện gen gây ung thư dẫn đến sự tiến triển của HCC.
Hơn nữa, các xét nghiệm ChIP cho thấy YAP hoạt động kết hợp với vùng tăng cường của gen OXTR, tăng cường biểu hiện OXTR. Điều này thiết lập một vòng phản hồi tích cực duy trì tín hiệu Hippo/YAP và sự tăng trưởng khối u.
Tiềm năng điều trị của Atosiban
Atosiban, một chất đối kháng OXTR cạnh tranh hiện đang được sử dụng lâm sàng để ngăn ngừa sinh non sớm, đã được chứng minh là phá vỡ vòng phản hồi tích cực OXTR-YAP, được thể hiện bằng sự tăng phosphorylization (hình thức không hoạt động) của YAP và ức chế biểu hiện gen gây ung thư phía sau.
Trong nhiều mô hình chuột HCC, bao gồm u xenograft và biến đổi gen, điều trị Atosiban đã ức chế đáng kể sự tăng trưởng khối u và giảm sự tăng sinh tế bào ung thư. Kết quả này nhấn mạnh tiềm năng sử dụng Atosiban như một tác nhân điều trị mới nhắm vào OXTR trong ung thư gan.
Bình luận chuyên gia
Nghiên cứu này cung cấp một khung cơ chế thuyết phục tích hợp tín hiệu GPCR với sự mất kiểm soát con đường tín hiệu Hippo/YAP trong HCC. Việc xác định OXTR là yếu tố thúc đẩy sự tiến triển khối u và khả năng điều chỉnh của nó bởi một thuốc đã được phê duyệt lâm sàng là một bước tiến hứa hẹn có thể tác động đến điều trị ung thư dịch chuyển.
Mặc dù thất bại của verteporfin trong các thử nghiệm lâm sàng đã làm giảm triển vọng của liệu pháp nhắm vào YAP, việc nhắm vào GPCRs thượng nguồn cung cấp một giải pháp thay thế khả thi với ít tác dụng phụ ngoại mục tiêu hơn. Việc tái sử dụng Atosiban đặc biệt hứa hẹn do hồ sơ an toàn đã được thiết lập trong thai kỳ. Tuy nhiên, cần có xác nhận lâm sàng để xác nhận hiệu quả và an toàn trong bệnh nhân HCC.
Hạn chế bao gồm bản chất chủ yếu là tiền lâm sàng của bằng chứng hiện tại và cần hiểu rõ hơn về sự dị质性在不同患者亚群中的OXTR表达。此外,结合Atosiban与现有HCC治疗方法的联合策略值得研究,以最大化治疗效益。
Kết luận
Tóm lại, công trình tiên phong này xác định thụ thể oxytocin là yếu tố điều chỉnh thượng nguồn quan trọng của con đường tín hiệu Hippo/YAP thúc đẩy sự phát sinh ung thư gan. Thuốc được FDA phê duyệt Atosiban hiệu quả trong việc chặn thụ thể này, phá vỡ một vòng phản hồi tích cực gây ung thư và ức chế sự tăng trưởng HCC trong các mô hình tiền lâm sàng phù hợp. Các phát hiện này cung cấp một mục tiêu phân tử mới và cách tiếp cận điều trị tái sử dụng cho ung thư gan, đáp ứng nhu cầu lâm sàng cấp bách. Các nghiên cứu lâm sàng tiếp theo nên đánh giá hiệu quả của Atosiban và tích hợp nó vào các phương pháp điều trị HCC.
Tài liệu tham khảo
1. Yang H, Cui J, Su P, et al. Oxytocin Receptor Regulates the Hippo/YAP Axis to Drive Hepatocarcinogenesis. Cancer Res. Published online July 31, 2025. doi:10.1158/0008-5472.CAN-24-3405