亮点
• 呼吸道病毒感染(流感和SARS-CoV-2)可在小鼠模型中唤醒肺实质中的休眠弥散性乳腺癌细胞(DCCs),促进其增殖和长期转移性生长。
• IL-6信号传导在早期再激活步骤中是必需的;CD4+ T细胞通过抑制抗肿瘤CD8+反应来维持生长。
• 人类注册分析(包括UK Biobank和Flatiron Health数据)显示,有记录的SARS-CoV-2感染的癌症患者癌症相关死亡率更高,肺转移风险增加。
研究背景和疾病负担
乳腺癌是全球最常见的恶性肿瘤之一,即使在表观缓解后,弥散性癌细胞(DCCs)仍可能在肺、骨和肝等远处器官中持续存在数年至数十年,处于非增殖的“休眠”状态。这些DCCs的再激活是晚期转移复发和癌症死亡的主要原因。了解打破休眠的触发因素可以为预防复发提供策略。
在早期COVID-19大流行期间,出现了无法完全用直接SARS-CoV-2死亡或诊断/治疗延迟解释的癌症相关超额死亡的观察信号。这引发了假设,即肺部感染——局部炎症的常见原因——可能会直接改变肺微环境,促进休眠DCCs的觉醒,从而增加转移复发。科罗拉多大学的研究小组在《自然》杂志上发表的文章(Respiratory viral infections awaken metastatic breast cancer cells in lungs, Nature, 2025)直接在临床前模型中测试了这一假设,并结合人类注册分析进行了补充。
研究设计
这项转化研究结合了机制性小鼠实验、体外测定和人类临床数据库的回顾性分析。
临床前模型:
• 小鼠模型:使用了两种已知会在肺中播种休眠DCCs的独立转移性乳腺癌小鼠模型。在病毒挑战之前,肿瘤细胞在肺中主要保持非增殖(休眠)状态。
• 病毒挑战:在适当的小鼠模型中进行流感病毒和SARS-CoV-2的实验感染。
• 干预和操作:采用基因敲除肿瘤细胞IL-6产生、体外IL-6处理和CD4+ T细胞耗竭的方法来解析机制。免疫表型和基因表达分析用于评估免疫细胞动力学(CD4+和CD8+ T细胞)和细胞因子信号传导。
人类数据分析:
• 数据库:作者查询了UK Biobank(涵盖多种癌症类型)和Flatiron Health电子健康记录衍生数据库(乳腺癌队列),以评估有记录的SARS-CoV-2感染与随后的癌症相关结果之间的关联。
• 结果:评估并比较了感染和未感染癌症患者的癌症相关死亡率和新发肺转移的发生率,调整了可用的协变量。
关键终点包括感染后(小鼠)肺中DCCs的数量和增殖状态变化、体外IL-6暴露下的肿瘤生长、免疫细胞组成变化以及人类结果的风险/比值估计。
主要发现
临床前结果(小鼠模型):
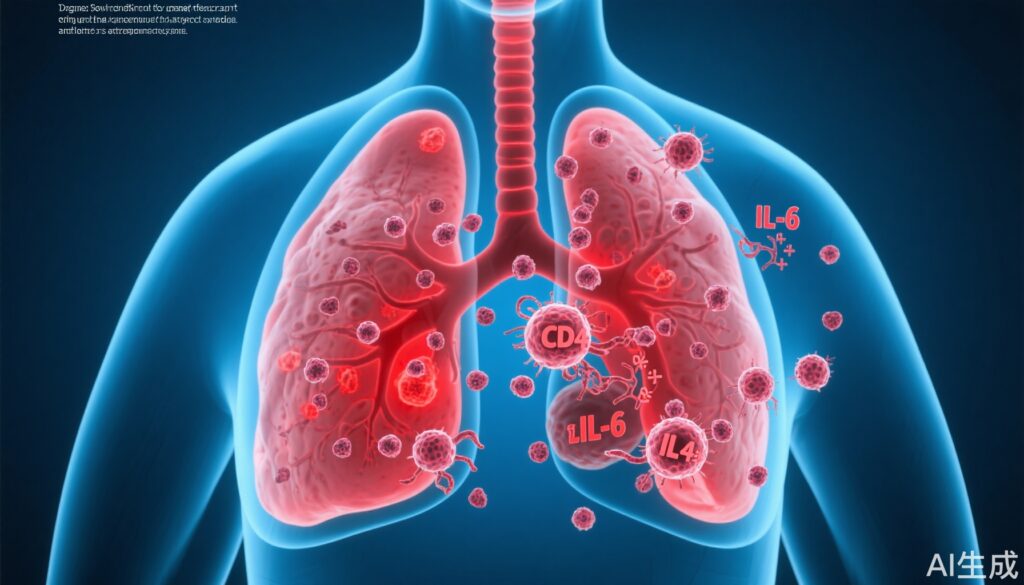
• 呼吸道病毒感染后的快速DCC再激活:在流感和SARS-CoV-2小鼠挑战实验中,肺中先前休眠的DCCs在感染后15天内显示出增殖增加。增殖持续时间长,在实验随访中可测量数月,最终形成明显的转移病灶。
• IL-6依赖性:DCCs和肺微环境中在病毒感染后显示出IL-6依赖性信号通路的激活。基因工程改造缺乏IL-6产生的肿瘤细胞在病毒挑战后增殖的DCCs显著减少,而IL-6功能正常的对照组则没有。体外实验中,外源性IL-6增加了乳腺癌细胞的生长,支持其直接的促增殖作用。
• IL-6和持续生长的时间动态:虽然感染后早期肺中IL-6蛋白水平显著升高,但在报告的实验中,肺中IL-6水平在约15天内恢复正常;然而,DCC增殖持续时间更长,表明IL-6可能启动再激活,但其他过程维持转移性生长。
• CD4+ T细胞在维持中的作用:病毒感染后,CD4+ T细胞被招募到含有DCCs的肺区域。实验性耗竭CD4+ T细胞不会改变早期(第9天)增殖的DCCs数量,但在后期时间点(第28天)减少了增殖的DCCs数量,表明CD4+ T细胞对于维持再激活的生长是必要的,但不是启动再激活的触发因素。
• CD4+细胞对CD8+细胞的抑制:基因表达和免疫表型分析显示,CD4+ T细胞耗竭导致肺中CD8+ T细胞增加。作者推断,感染期间招募的CD4+ T细胞可能限制CD8+介导的抗肿瘤监视,允许持续的DCC扩展。
人类注册分析结果:
• 一致的临床信号:使用UK Biobank和Flatiron数据,研究显示有记录的SARS-CoV-2感染的癌症患者癌症相关死亡率显著更高,发生肺转移的风险增加,与未感染的癌症患者相比。作者强调,这些观察性关联与临床前机制一致,但单独不能证明因果关系,因为可能存在混杂因素。
安全性及不良反应观察:
• 临床前论文侧重于机制,未报告经典药物或治疗安全数据。从转化角度来看,该研究提出了潜在的治疗假设(例如,靶向IL-6信号传导或调节CD4+/CD8+平衡),但这些策略需要仔细评估,因为这些途径在病毒防御和组织修复中起着核心作用。
专家评论和机制可信度
生物学可信度:这些发现与炎症和癌症进展之间的既定联系一致。细胞因子如IL-6是急性炎症反应的中心介质,长期以来一直被认为与肿瘤细胞增殖、生存和肿瘤微环境的调节有关(Grivennikov等人,Cell 2010)。IL-6可以通过STAT3激活直接作用于肿瘤细胞,促进增殖和生存,也可以通过塑造免疫细胞募集和间质重塑间接发挥作用。
免疫调节:观察到CD4+ T细胞通过限制CD8+介导的控制来支持持续的DCC生长,这与CD4+亚群——辅助性和调节性——在炎症期间的复杂角色一致。CD4+调节性T细胞(Tregs)可以抑制细胞毒性反应并促进组织修复;在病毒感染后的炎症环境中,这种抑制可能会无意中保护再激活的肿瘤细胞免受消除。
临床意义:如果得到证实和推广,这些数据表明呼吸道感染是转移复发的可修改风险因素,特别是对于常在肺中播种的癌症。这引发了关于幸存者护理和癌症患者及幸存者的感染预防策略的实际问题。
局限性和替代解释:
• 临床前局限性:小鼠模型不能完全重现人类癌症生物学、免疫谱系、既往治疗、合并症或人类病毒暴露的复杂性。实验中使用的病毒的时机、剂量和株系会影响免疫反应,可能与典型的人类感染不匹配。
• 人类数据约束:观察性注册分析受混杂因素影响(例如,健康状况差异、社会经济因素、癌症分期、治疗中断、疫苗接种状态)。尽管进行了调整,反向因果关系(例如,健康较脆弱的人更容易患严重COVID-19并死于癌症)仍然是一种可能性。
• 治疗谨慎:IL-6阻断剂(例如,托珠单抗)在COVID-19中用于治疗高炎症;然而,将IL-6抑制剂用于减少转移风险将非常复杂,因为IL-6对感染控制和组织修复至关重要。同样,广泛耗竭CD4+ T细胞将具有免疫抑制作用且不安全。
与先前文献的联系:先前的研究记录了疫情期间癌症死亡人数的增加和筛查/诊断的减少(例如,Kaufman等人,JAMA Netw Open 2020;Maringe等人,Lancet Oncol 2020)。《自然》研究增加了机制层面的证据,表明感染本身,独立于诊断和治疗中断,可能在生物学上导致更差的癌症结果。
临床和研究意义
对于临床医生:
• 预防重点:加强癌症幸存者的呼吸道感染预防——按照指南进行疫苗接种(流感、COVID-19),必要时早期抗病毒治疗,以及标准的感染控制措施——特别是在已知会在肺中播种的癌症患者中。
• 在呼吸道感染期间和之后保持警惕:考虑在严重呼吸道感染后对适当患者进行更密切的监测,以寻找转移复发的迹象或症状,同时权衡过度检测的风险和成本。
• 治疗研究谨慎:现有的免疫调节药物(IL-6抑制剂、免疫检查点抑制剂)提供了潜在的转化路径,但不应在没有严格的临床试验的情况下经验性地重新用于转移预防。
对于研究人员:
• 重复和扩展:在其他肿瘤类型和捕捉既往治疗和免疫衰老的模型中进行独立复制是必不可少的。
• 机制剖析:识别超出短暂IL-6升高的持久生长的维持因素(基质重塑、间质细胞变化、持久的T细胞极化)。
• 干预试验:精心设计的转化试验可以测试围感染期策略(例如,针对感染的靶向细胞因子调节),但必须权衡感染控制和肿瘤安全性。
结论
《自然》论文提供了令人信服的临床前证据,表明常见的呼吸道病毒可以通过IL-6介导的初始机制和CD4+ T细胞依赖的CD8+控制抑制来唤醒肺中的休眠乳腺癌DCCs并触发持久的转移性生长。与小鼠研究一起呈现的观察性人类数据显示,SARS-CoV-2感染后癌症相关死亡率和肺转移风险增加。虽然人类中的因果关系仍有待完全确定,但这项工作确定了一条潜在的可修改途径,将感染、炎症和转移复发联系起来,并强调了癌症幸存者中感染预防和靶向机制研究的重要性。
参考文献
1. 科罗拉多大学作者. 呼吸道病毒感染唤醒肺中转移性乳腺癌细胞. 自然. 2025. https://www.nature.com/articles/s41586-025-09332-0
2. Kaufman HW, Chen Z, Niles J, Fesko Y. 新冠肺炎(COVID-19)大流行前后美国新诊断癌症患者数量的变化. JAMA Netw Open. 2020;3(8):e2017267. doi:10.1001/jamanetworkopen.2020.17267 IF: 9.7 Q1 3. Maringe C, Spicer J, Morris M, 等. 英国因新冠肺炎(COVID-19)大流行导致的癌症死亡人数的影响:一项全国性的、基于人群的建模研究. 兰克肿瘤学. 2020;21(8):1023-1034. doi:10.1016/S1470-2045(20)30388-0 IF: 35.9 Q1 4. Grivennikov SI, Greten FR, Karin M. 免疫、炎症和癌症. 细胞. 2010;140(6):883-899. doi:10.1016/j.cell.2010.01.025 IF: 42.5 Q1 5. Schreiber RD, Old LJ, Smyth MJ. 癌症免疫编辑:整合免疫在癌症抑制和促进中的作用. 科学. 2011;331(6024):1565-1570. doi:10.1126/science.1203486