序論
心房細動(AF)は、ヨーロッパ系の人々の生涯の約3分の1に影響を与える一般的な心臓不整脈です。肥満はAFの確立された修正可能な危険因子ですが、BMIなどの従来の指標は脂肪分布のニュアンス、特に異所性脂肪貯蔵庫を捉えきることができません。心外膜脂肪組織(EAT)は心筋を包む内臓脂肪室であり、局所的なパラクリンメカニズムを通じて炎症と線維化を促進し、AFの病態を影響すると考えられています。しかし、EATと既存のAFとの関連は報告されていますが、一般集団における新規発症AFの予測因子としての役割はまだ明確ではありません。本研究では、大規模なデンマークコホートにおいて、CT血管造影(CTA)で測定したEAT量と新発性AFの発症リスクとの関連を明らかにすることを目的としました。
研究デザイン
本研究は、コペンハーゲン一般人口研究(CGPS)という特徴のよく把握されたコペンハーゲン大都市圏の集団ベースのコホート内で実施されました。2010年2月から2012年2月の間に、40歳以上の腎機能が保たれている(血清クレアチニン<100 µmol/L)参加者が心臓CTAを受け、EAT量を測定するよう招待されました。AFの既往歴がある人は除外され、新規発症症例に焦点を当てました。主要なエンドポイントは、国際疾病分類第10版(ICD-10)コードI48に基づいてデンマーク国民患者レジストリから取得された新発性AFでした。AFのICD-10診断は確認された陽性的中率が92%以上であり、信頼性のある症例識別が可能です。二次エンドポイントには、全国死亡登録簿から得られた全原因による死亡が含まれました。
リスク因子は、標準化された質問票と臨床評価を通じて包括的に評価されました。これらには、血圧、BMI、血糖値、肺機能検査、喫煙やアルコール摂取などの生活習慣因子が含まれます。高血圧は、収縮期/拡張期血圧≥140/90 mmHgまたは関連薬剤の使用で定義されます。糖尿病の分類には、自己申告の診断またはプラズマ血糖値≥11.1 mmol/Lが含まれます。慢性閉塞性肺疾患(COPD)は、肺機能検査基準(FEV1/FVC<70%)で定義されます。EAT量は、確立された閾値がないため、分析のために4分位に分類されました。
主な知見
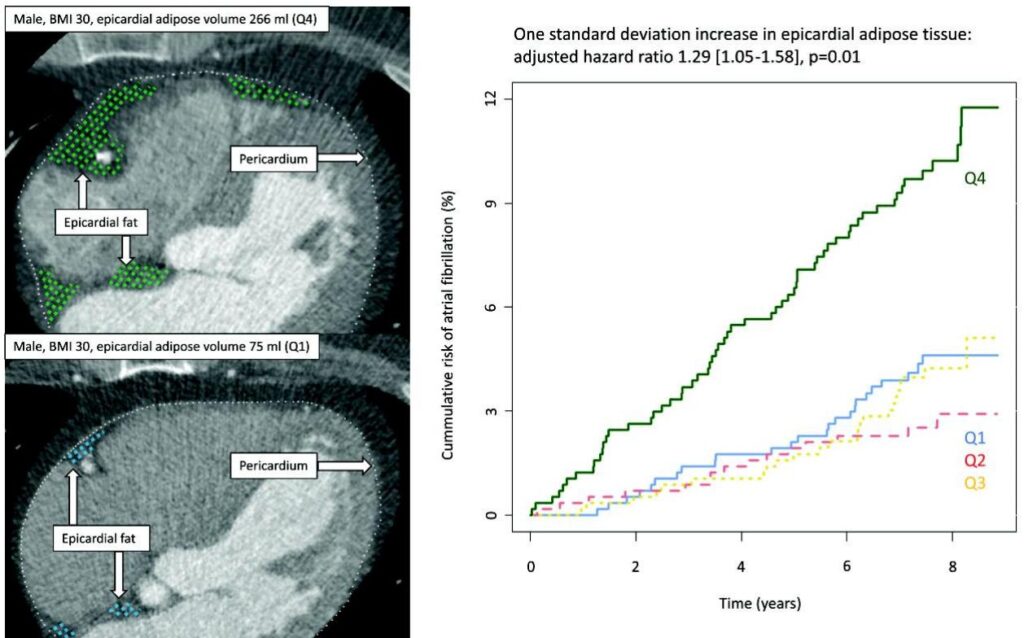
2292人の適格な参加者(平均年齢59.4±10.3歳、女性54%)の中央追跡期間7.7年間で、123件(5.4%、1000人年あたり7.2件)の新発性AF症例が発生しました。高いEAT量の基線予測因子には、高齢、男性、BMIの上昇、現在の喫煙状況、アルコール摂取量の多さ、COPDの存在が含まれました。
重要なのは、多変量コックス回帰モデルでBMI、高血圧、喫煙、アルコール摂取、糖尿病、左心房容積、COPD、出生年を調整した場合、EAT量の1標準偏差増加はAFの発症リスクが29%上昇することを示したことです(HR 1.29, 95% CI: 1.05–1.58, P = 0.01)。EATの4分位に分けて分析した結果、絶対的なAFリスクが段階的に上昇し、最高4分位(Q4)では累積発症率が11.4%となり、最低4分位(Q1)の4.6%と比較して有意差が認められました(Gray’s test P < 0.001)。注目に値するのは、EATの4分位間で全原因による死亡率に有意な違いは認められず、EATのAFリスクとの関連が全体の死亡率とは異なることを示唆していることです。
専門家のコメントと生物学的根拠
本研究の知見は、EATがプロ炎症性および線維化性アディポキニン(アディポフィブロキニン)を分泌する能動的な内分泌器官として作用し、心筋の再構成とAFの発生に好都合な電気特性をもたらすというメカニズム的証拠と一致しています。より短い追跡期間や感度の低いAF検出方法(単一ECG記録など)に制限されていた以前の研究と比較して、本コホートは検証済みのレジストリベースのエンドポイントと長期の追跡を用いたことで、関連の堅牢性と臨床的重要性が向上しました。
これらの長所にもかかわらず、いくつかの制限点が考慮されるべきです。CTAスキャンを志願する参加者は、健康状態や行動面で一般集団と異なる可能性がある選択バイアスの可能性があります。一過性または無症状のAFエピソードは検出されず、真の発症率が過小評価される可能性があります。観察研究であるため、因果推論は限定的であり、身体活動レベルや全身性炎症からの残存混雑要因が考えられます。
結論
このデンマークの前向きコホート研究は、BMIや他の混雑要因とは独立して、心外膜脂肪組織量の増加が新発性心房細動のリスクを有意に高めることを裏付けています。これらの結果は、BMIのみでのリスク層別化の不十分さを示し、特にEATのような異所性脂肪貯蔵庫が局所的な炎症と線維化経路を通じて不整脈を引き起こす新興パラダイムを支持しています。
EATはライフスタイル介入や薬物療法により変更可能であるため、これらの知見は標的を絞ったAF予防戦略の道を開きます。将来の縦断研究や介入研究では、繰り返しEATを測定することで因果関係を解明し、EATの治療的削減がAF発症率の低下につながるかどうかを評価することが重要です。
参考文献
1. Van Gelder IC, Rienstra M, Bunting KV, Casado-Arroyo R, Caso V, Crijns HJGM, et al. 2024 ESC guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): developed by the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC), with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Endorsed by the European Stroke Organisation (ESO). Eur Heart J 2024;45:3314–414. https://doi.org/10.1093/eurheartj/ehae176
2. Sacks HS, Fain JN. Human epicardial adipose tissue: a review. Am Heart J 2007;153:907–17. https://doi.org/10.1016/j.ahj.2007.03.019
3. Venteclef N, Guglielmi V, Balse E, Gaborit B, Cotillard A, Atassi F, et al. Human epicardial adipose tissue induces fibrosis of the atrial myocardium through the secretion of adipo-fibrokines. Eur Heart J 2015;36:795–805. https://doi.org/10.1093/eurheartj/eht099
4. Antonopoulos AS, Sanna F, Sabharwal N, Thomas S, Oikonomou EK, Herdman L, et al. Detecting human coronary inflammation by imaging perivascular fat. Sci Transl Med 2017;9:eaal2658. https://doi.org/10.1126/scitranslmed.aal2658
5. Thanassoulis G, Massaro JM, O’Donnell CJ, Hoffmann U, Levy D, Ellinor PT, et al. Pericardial fat is associated with prevalent atrial fibrillation: the Framingham Heart Study. Circ Arrhythm Electrophysiol 2010;3:345–50. https://doi.org/10.1161/CIRCEP.109.912055
6. Rix TA, Riahi S, Overvad K, Lundbye-Christensen S, Schmidt EB, Joensen AM. Validity of the diagnoses atrial fibrillation and atrial flutter in a Danish patient registry. Scand Cardiovasc J 2012;46:149–53. https://doi.org/10.3109/14017431.2012.673728
7. Kühl JT, Lønborg J, Fuchs A, Andersen MJ, Vejlstrup N, Kelbæk H, et al. Assessment of left atrial volume and function: a comparative study between echocardiography, magnetic resonance imaging and multi slice computed tomography. Int J Cardiovasc Imaging 2012;28:1061–71. https://doi.org/10.1007/s10554-011-9930-2
8. Elming MB, Lønborg J, Rasmussen T, Kühl JT, Engstrøm T, Vejlstrup N, et al. Measurements of pericardial adipose tissue using contrast enhanced cardiac multidetector computed tomography—comparison with cardiac magnetic resonance imaging. Int J Cardiovasc Imaging 2013;29:1401–7. https://doi.org/10.1007/s10554-013-0218-6
9. Iacobellis G. Epicardial adipose tissue in contemporary cardiology. Nat Rev Cardiol 2022;19:593–606. https://doi.org/10.1038/s41569-022-00679-9
10. Mahabadi AA, Geisel MH, Lehmann N, Lammerding C, Kälsch H, Bauer M, et al. Association of computed tomography-derived left atrial size with major cardiovascular events in the general population: the Heinz Nixdorf Recall Study. Int J Cardiol 2014;174:318–23. https://doi.org/10.1016/j.ijcard.2014.04.068