序論
循環RNA(circRNA)は、共价閉鎖ループ非コーディングRNAのクラスであり、がんや免疫調整を含む多くの生物学的過程における重要な調節因子として注目されています。circRNAは、独自の安定した構造と、miRNA、RNA結合たんぱく質(RBP)、翻訳機械との複雑な相互作用能力を持つことで、腫瘍進行と腫瘍微小環境(TME)に影響を与えます。特にがん免疫療法におけるバイオマーカーと治療標的としての有望な役割から、circRNAの生合成、機能、および翻訳可能性に関する包括的な理解が必要です。
circRNAの生合成と機能的メカニズム
circRNAは主に、前駆mRNA(pre-mRNA)の逆スプライシング機構を通じて生成されます。この機構では、下流のスプライスドナー部位が上流のスプライスアクセプター部位と結合して閉鎖した循環RNAが形成されます。circRNAの生成は、転写伸長速度によって動的に制御され、内含子の相補配列やQuaking(QKI)やHuRなどの反応因子によって調節されます。circRNAの核輸出は、その長さとRNAヘリカーゼ(DDX39A/B)との相互作用に依存し、NXT1-NXF1ヘテロ二量体によって核孔複合体を介した転移が促進されます。
機能的には、circRNAは以下の複数の検証済みおよび推定されるメカニズムを通じて作用します:
1. miRNAスポンジ:circRNAには特定のmiRNAに対する複数の結合部位があり、それらがmiRNAを隔離し、標的mRNAに対する抑制を緩和することができます。これはCDR1asがmiR-7を隔離してEGFRなどの発がん遺伝子の表現を調節する例です。
2. RBP相互作用:circRNAはRBPと結合し、自身の安定性、核保留、生合成に影響を与え、間接的に遺伝子表現を調節します。HuRとの相互作用が見られるcircPABPN1はこのメカニズムの例です。
3. たんぱく質の足場:一部のcircRNAは、複数のたんぱく質を組み立てるプラットフォームとして機能し、細胞周期進行やアポトーシスに影響を与えます。circFoxo3がp21とCDK2を複合化する例があります。
4. 翻訳テンプレート:新規証拠は、circRNAが内部リボソームエントリサイト(IRES)を介して機能的なペプチドを翻訳する可能性を示しています。これは遺伝子調節の新しい層を加えますが、さらなる検証が必要な分野です。
circRNAの免疫調整と腫瘍微小環境での役割
circRNAは、TME内の様々な免疫細胞やチェックポイントに影響を与えることにより、免疫応答を複雑に調整します:
– T細胞:circRNA由来の隠れたペプチドは、MHCクラスI分子によって腫瘍細胞で処理され、提示され、CD8+細胞障害性T細胞反応やサイトカイン分泌(IFN-γ、TNF-α)を誘導し、抗腫瘍免疫を強化します。
– 自然キラー(NK)細胞:circPHLPP2はIL36γの転写を調節することにより、大腸がんにおけるNK細胞の浸潤と細胞障害機能を抑制し、免疫回避に寄与します。
– マクロファージの極化:エクソソームを介したcircZNF451のマクロファージへの送達は、それらを免疫抑制的なM2表型へと歪め、抗腫瘍免疫を阻害します。
– 免疫チェックポイント:circRNAは、これらの免疫チェックポイントmRNAを標的とするmiRNAをスポンジすることで、PD-L1やCTLA-4の表現を調節し、腫瘍免疫逃走を促進します。
特定のがんにおけるcircRNAの役割
広範な前臨床研究では、複数のがん種におけるcircRNAが特徴づけられています:
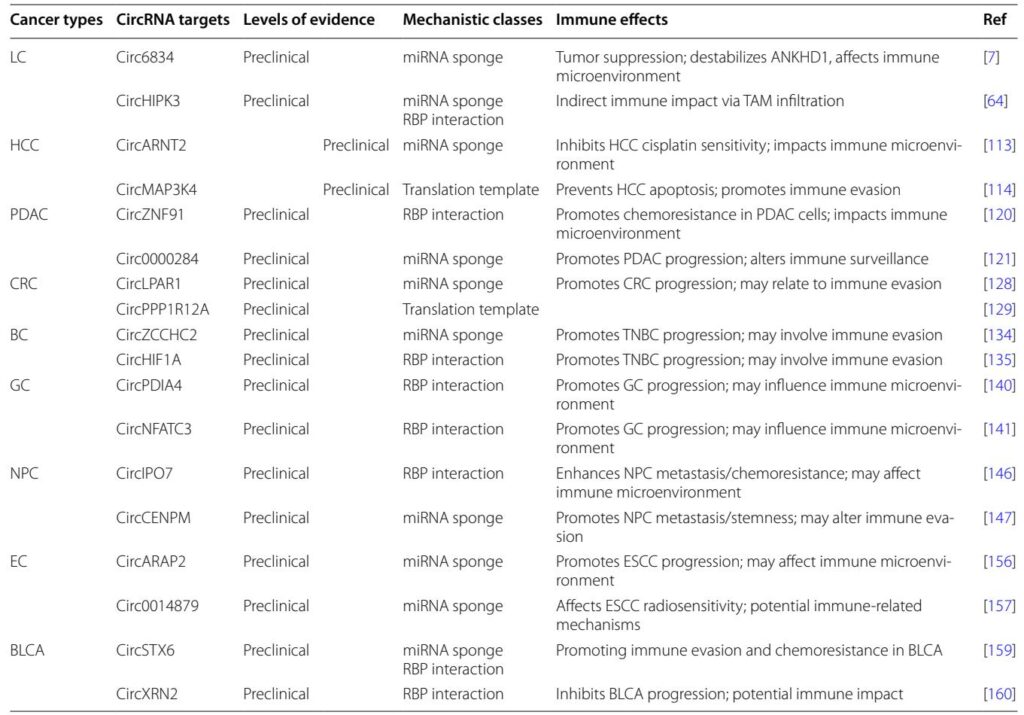
– 肺がん:circ6834とcircHIPK3は、それぞれ腫瘍進行とマクロファージ浸潤を調節し、免疫環境に影響を与えます。
– 肝細胞がん:circARNT2はmiRNAスポンジによってシスプラチン感受性を低下させ、circMAP3K4はアポトーシスを防ぐペプチドをコードします。
– 膵臓管腺がん:circZNF91はRBPを介したメカニズムによって化学抵抗性を促進し、circ_0000284はmiRNA相互作用によって腫瘍成長を促進します。
– 大腸がん:circLPAR1とcircPPP1R12Aは、miRNAスポンジと発がんペプチドのコードによって増殖と転移を促進します。
– 乳がんと胃がん:多くのcircRNAが、RBP結合やmiRNAスポンジ活動など、多様なメカニズムを通じて腫瘍進行と免疫回避に参加します。
さらに、鼻咽頭がん、食道がん、膀胱尿路上皮がんも、腫瘍生物学と免疫調整におけるcircRNAの関与を示しており、主に前臨床段階で研究されています。
新規治療応用
– カルT細胞療法:circRNAの高安定性を活用し、カルT細胞に組み込まれたエンジニアリングされたcircRNAは、持続性、特異性、効果性の向上を目指しており、特に固形腫瘍に対して有望です。前臨床データは有望ですが、腫瘍浸潤やT細胞疲労などの課題が残っています。
– circRNAベースのワクチン:circRNAワクチンは、直鎖mRNAワクチンよりも安定性が高く、抗原提示が長期化し、動物のがんモデルで強力な樹状細胞とCD8+ T細胞反応を誘導します。circRNA翻訳から得られる新規がんネオアンチジェンは、ワクチン標的を拡大します。
– circRNAデータベース:MiOncoCircやTCCIAなどのリソースは、circRNAプロファイルと免疫療法反応を統合し、バイオマーカーの発見と治療標的の同定を促進します。技術的および検証の課題が存在します。
課題と将来の方向性
circRNA生物学の臨床応用への翻訳は、大きな障壁に直面しています。これらには、circRNAの生合成と分解の不完全な理解、デリバリーシステムの効率の低さ、潜在的な免疫原性、オフターゲット効果が含まれます。製造のスケーリング、厳格な前臨床安全性評価、大規模な臨床試験が不可欠です。circRNAワクチンとカルT療法の組み合わせは、抗腫瘍免疫を協調的に強化する可能性があります。検出方法の標準化と多オミクスの統合は、発見と翻訳を加速します。
結論
circRNAは、多機能性の高い規制RNAのクラスであり、がん進行と免疫療法において重要な意味を持っています。miRNAスポンジ、たんぱく質相互作用、ネオアンチジェン生成などの多様なメカニズムを通じて、circRNAは腫瘍免疫とTMEを調節します。バイオマーカーと治療剤としての可能性はありますが、臨床応用には技術的および生物学的な課題を克服する必要があります。デリバリーの最適化、メカニズム経路の解明、circRNAベースのモダリティの統合に関する今後の研究は、がん免疫療法の進歩に貢献する可能性があります。
参考文献
Hansen TB, Jensen TI, Clausen BH, Bramsen JB, Finsen B, Damgaard CK, et al. Natural RNA circles function as efficient microRNA sponges. Nature. 2013;495(7441):384–8.
Yan Wang et al., CircRNAs: functions and emerging roles in cancer and immunotherapy. Mol Cancer. 2025; [As detailed in the provided article].