引言
神经退行性疾病(NDs),包括阿尔茨海默病(AD)、帕金森病(PD)、中风、肌萎缩侧索硬化症(ALS)、亨廷顿病(HD)、多发性硬化症(MS)和癫痫,给全球带来了巨大的发病率和死亡率。这些疾病以进行性的神经元功能障碍为特征,涉及复杂的致病机制,如蛋白质错误折叠和聚集、线粒体功能障碍、氧化应激和慢性神经炎症。尽管进行了广泛的研究,目前的治疗方法主要提供对症缓解,无法阻止疾病进展。因此,迫切需要创新的治疗策略。
外泌体——来自多种细胞类型的小型细胞外囊泡(30–100 nm)——作为中枢神经系统(CNS)中强有力的细胞间通讯介质而崭露头角。它们的固有特性,包括能够穿越血脑屏障(BBB)、低免疫原性和天然的货物携带能力,使外泌体成为输送治疗分子和作为早期诊断生物标志物的有吸引力的候选者。
本文回顾了外泌体在神经退行性疾病中的治疗潜力,并详细介绍了通过基因、化学和纳米材料修饰提高其靶向性和疗效的新兴策略。我们重点介绍了最近的临床前发现,讨论了当前的局限性,并探讨了未来临床转化的前景。
外泌体在神经退行性疾病中的应用
外泌体通过胞内加工起源于细胞内,并释放到细胞外空间,携带蛋白质、脂质、mRNAs、microRNAs(miRNAs)和其他生物活性分子。外泌体通过转移这些货物影响受体细胞,从而调节免疫反应、突触功能和细胞稳态。
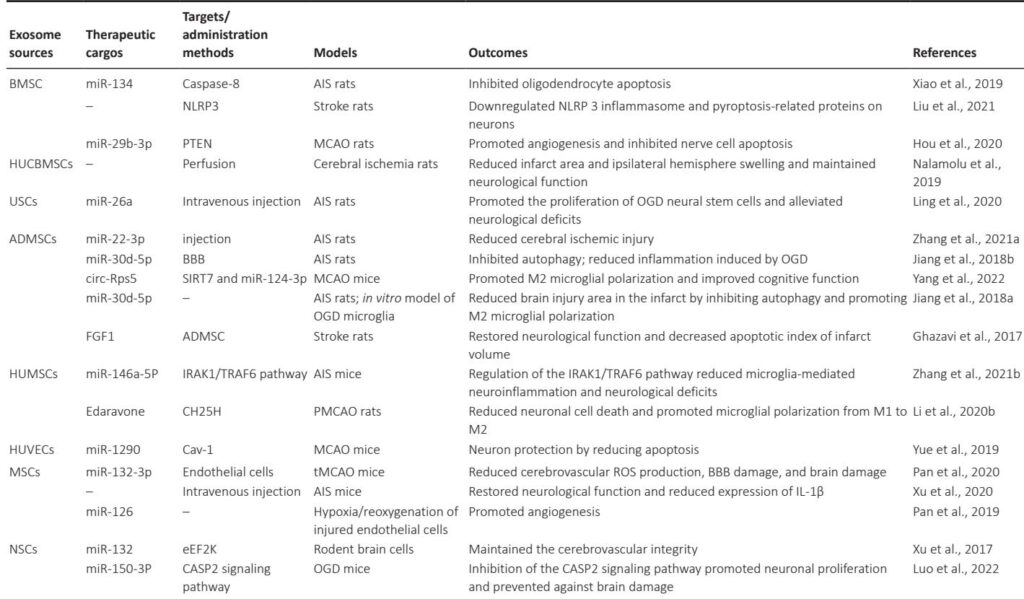
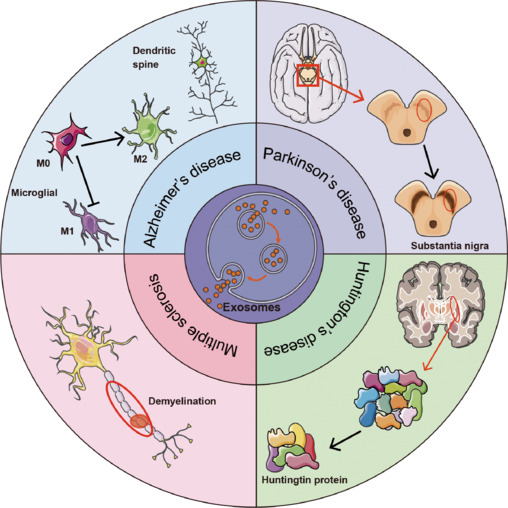
在阿尔茨海默病中,外泌体既参与病理传播又参与淀粉样蛋白-β(Aβ)和tau聚集的清除。间充质干细胞来源的外泌体(MSC-exosomes)负载治疗性miRNAs(例如,miR-223靶向PTEN)显示出神经保护作用,减少炎症和神经元凋亡,改善动物模型的认知结果。用狂犬病毒糖蛋白(RVG)肽修饰的工程化外泌体表现出增强的BBB穿透能力和小胶质细胞摄取,进一步放大治疗递送效果。
在帕金森病中,外泌体提供了输送抗氧化酶、神经营养因子和siRNAs(靶向α-突触核蛋白聚集)的载体。许多研究表明,施用MSC-exosomes可以减轻多巴胺能神经元损失,减少神经炎症,并恢复啮齿类动物模型的运动功能。携带miR-133b的外泌体促进轴突生长,增强突触可塑性。
中风管理受益于外泌体递送血管生成和神经生成因子,如从人尿或骨髓来源的干细胞中提取的miR-210和miR-126。外泌体减少梗死面积,抑制神经元凋亡,调节小胶质细胞活化,加快功能恢复。重要的是,外泌体的内源性质有利于靶向和避免免疫清除,优于合成纳米颗粒。
除此之外,外泌体在ALS、HD、MS和癫痫中通过调节神经炎症、氧化应激和致病性蛋白质聚集显示出有希望的效果,表明其在多种NDs中的广泛应用潜力。
外泌体的修饰以增强靶向性和治疗效率
虽然天然外泌体表现出显著的治疗能力,但其缺乏固有的靶细胞特异性限制了临床应用,因为它们会被非靶组织摄取并降低疗效。因此,新兴技术集中在工程化外泌体以优化靶向、装载和递送。
基因工程
基因修饰涉及将编码融合蛋白的质粒转染到产生外泌体的细胞中,这些融合蛋白在外泌体膜蛋白(例如Lamp2b)上附加靶向配体或肽。这种方法使得表面展示配体,如RVG,增强CNS靶向性,或心脏特异性肽用于心脏病。
例子包括CD9-HuR融合以促进siRNA装载,以及Fe65肽融合以靶向淀粉样前体蛋白,促进AD模型中的自噬诱导。基因工程允许精确的配体结合,但需要复杂的制造过程和高成本。
化学修饰
化学方法包括共价和非共价表面功能化。共价修饰主要采用正交点击化学,利用叠氮-炔环加成反应连接靶向基团或纳米粒子。例如,与超顺磁性氧化铁纳米粒子(SPIONs)和神经纤毛蛋白-1靶向肽偶联的外泌体展示了改进的胶质瘤靶向和成像能力。
非共价策略利用静电相互作用、配体-受体结合、与脂质体的疏水融合、适配子掺入和CP05肽锚定到CD63外泌体四跨膜蛋白。这些方法允许可逆的表面修饰,对外泌体完整性影响最小。例如,通过DOPE-NHS连接子固定的RVG肽增加了MSC-exosomes的脑递送。
纳米材料整合
与纳米材料的整合扩展了外泌体的功能。金属有机框架和金纳米粒子在外泌体上或内部的整合有助于药物装载、追踪和控制释放。纳米材料增强的外泌体提高了药物稳定性、靶向积累和实时成像,支持诊疗一体化应用。
研究人员已成功使用纳米材料修饰的外泌体递送疏水药物,并在PD模型中清除致病性蛋白质如α-突触核蛋白,突显了其在克服药物溶解性挑战和提高治疗效果方面的实用性。
| Diseases | Exosome sources | Therapeutic cargos | Targets/administration methods | Models | Outcomes | References |
|---|---|---|---|---|---|---|
| ALS | ADMSCs | – | SOD1 | SOD1-G93A mice | Reduced glial cell activation in mice | Bonafede et al., 2020 |
| MSCs | miR-467f; miR-466q | MAPK signaling pathway | SOD1-G93A mice | Downregulated TNF, IL-6 and IL-1β expression Inhibited Map3k8 and Mk2 and thus the pro-inflammatory phenotype of microglia | Giunti et al., 2021 | |
| NSCs | miR-124a | Striata | SOD1-G93A mice | Reduced GLT1 protein expression in mice | Morel et al., 2013 | |
| HD | ADMSCs | – | Htt | R6/2 transgenic HD mice | Upregulated PGC-1 levels to improve mitochondrial dysfunction | Lee et al., 2016b |
| HEK 293 cells | miR-124 | Striata | R6/2 transgenic HD mice | Reduced expression of REST protein of target genes | Lee et al., 2017 | |
| Serum | – | Intravenous injection | R6/2 transgenic HD mice | Improved weight loss and survival in HD mice | Lee et al., 2021 | |
| MSCs | hsiRNA | Striata | Wild-type mice | Reduced Htt expression | Didiot et al., 2016 | |
| MS | NSCs | Montelukast | GPR17 | Cuprizone-treated mice | Promoted myelination | Xiao et al., 2022 |
| Bryostatin-1 | GPR17 | Cuprizone-treated mice | Promoted myelination | Wu et al., 2022 | ||
| Dendritic cells | IFNγ | Intranasally | MS mice | Promoted myelination in the CNS | Pusic et al., 2014 | |
| ADMSCs | – | Intranasally | EAE mice | Significantly reduced CNS tissue lesions | Fathollahi et al., 2021 | |
| MSCs | Carboxylic acid functionalized LJM-3064 aptamers | Amine groups on the surface of exosomes | C57BL/6 mice | Reduced area of demyelinating lesions of the central nervous system | Hosseini Shamili et al., 2019 | |
| EP | BMSCs | – | Hippocampus | LPS EP mice | Weakened microglial activation, and reduced hippocampal neuroinflammation | Long et al., 2017 |
局限性和挑战
尽管临床前结果令人鼓舞,但外泌体治疗的临床转化面临若干障碍。外泌体来源的变异性、货物组成的异质性和大规模纯化的挑战使得标准化复杂。外泌体表现出较短的系统半衰期和快速清除,需要优化以实现持续的治疗效果。
由于意外与非靶细胞的相互作用或致病性蛋白质的转移,潜在的不良效应需要严格的安评评估。使用干细胞来源的外泌体引发伦理问题,特别是在来源材料和监管监督方面。
技术挑战包括有效的货物装载、储存稳定性以及开发高产量、可重复生产的高产方法。需要先进的表征和成像技术来准确跟踪外泌体的生物分布和体内命运。
结论与未来展望
外泌体因其能够穿越血脑屏障并介导细胞间通讯的固有能力,成为诊断和治疗神经退行性疾病的新颖且多功能平台。干细胞来源的外泌体在多种ND模型中表现出强大的再生、免疫调节和神经保护作用。此外,通过基因工程、化学偶联和纳米材料整合的表面修饰显著提高了靶向特异性和治疗效果。
为了实现其临床潜力,未来研究必须集中解决生产规模、纯化标准、安全性分析和受控货物装载等问题。跨学科努力整合纳米技术、分子生物学和临床神经科学将是关键。
最终,基于工程化外泌体的平台有望成为精准医疗工具,为有效治疗改变破坏性神经退行性疾病的过程带来希望。
Reference
Chen H, Li N, Cai Y, Ma C, Ye Y, Shi X, Guo J, Han Z, Liu Y, Wei X. Exosomes in neurodegenerative diseases: Therapeutic potential and modification methods. Neural Regen Res. 2026 Feb 1;21(2):478-490. doi: 10.4103/NRR.NRR-D-24-00720IF: 6.7 Q1 . Epub 2024 Oct 22. PMID: 40326981IF: 6.7 Q1 ; PMCID: PMC12220696IF: 6.7 Q1 .