ハイライト
- 複数の前向き人間研究で、冠動脈血、心肺バイパス(CPB)曝露血、頸動脈アテローマから微細プラスチックとナノプラスチック(MNP)が検出されました。
- MNPの存在は局所的な炎症マーカーと全身的な炎症マーカー、ならびに観察コホートでの主要な悪性心血管イベント(MACE)のリスク上昇と相関しています。
- 事前臨床証拠に基づく生物学的説明可能性がありますが、汚染の可能性、方法論の異質性、残存混在要因により、因果関係はまだ証明されていません。
研究背景と疾患負担
微プラスチック(粒子径<5 mm)とナノプラスチック(<1000 nm)は、大型のプラスチック製品が光化学的、機械的、または生物的過程によって分解される際に生成される普遍的な環境汚染物質です。世界的な暴露は摂取、吸入、皮膚接触を通じて起こります。研究では、胎盤、母乳、尿、血液、肺、肝臓などの人間の生体材料からMNPが検出されています。新興の毒性学文献(細胞培養モデルと動物モデル)では、MNPが酸化ストレス、内皮炎、アポトーシス、心拍数の変化、心筋機能障害と線維症、血管機能障害を引き起こすことが示されています。心血管疾患(CVD)は世界中で最も一般的な死亡原因であり、MNP暴露がCVDリスクに寄与する場合、公衆衛生への影響は大きくあります。しかし、最近まで、MNP負荷が血管病変や臨床イベントと直接関連する人間のデータは限られていました。
研究設計と方法(3つの研究の概要)
3つの前向き観察的人間研究でMNP検出と臨床的関連性が報告されています。
– 研究1: 心筋梗塞における冠動脈血(Zhang et al., J Hazard Mater 2025)。心筋梗塞の冠動脈造影を受けた142人の患者を対象とした前向き観察コホート研究。冠動脈血サンプルは、ポリマーの種類と濃度を解析するために熱分解ガスクロマトグラフィー質量分析法(Py-GC/MS)を使用しました。臨床イベントのフォローアップは、110人の患者で平均31.5か月でした。
– 研究2: 小児におけるCPB曝露(Wu et al., J Hazard Mater 2025)。先天性心疾患手術で心肺バイパスを受けた22人の小児を対象とした前向き観察研究。CPB前後のペア血サンプルは、Py-GC/MSとレーザー直接赤外分光法(LDIR)、走査電子顕微鏡による粒子可視化が行われました。臨床検査室での相関性(白血球数と好中球数)も調査されました。
– 研究3: アテローマと心血管イベント(Marfella et al., N Engl J Med 2024)。無症状の頸動脈狭窄症の手術(頸動脈内膜剥離術)を受けた304人の患者を対象とした多施設前向き観察研究。摘出されたプラークは、Py-GC/MS、安定同位体分析、電子顕微鏡で解析され、炎症性バイオマーカーはELISAと免疫組織化学で評価されました。主要エンドポイントは、フォローアップ期間(平均約34か月)中の心筋梗塞、脳卒中、または死亡の複合体でした。
共通の実験室モダリティには、ポリマーの同定/定量用のPy-GC/MSと、粒子の可視化や元素分析用の顕微鏡/分光法が含まれます。これらの方法は補完的な化学的および形態学的情報を提供しますが、それぞれ異なる長所と短所があります。
主要な知見
このセクションでは、各研究の主要な結果を要約し、その意味を比較します。
– 冠動脈血におけるMI(Zhang et al.):110人のフォローアップを完了した患者のうち、冠動脈血中のポリマー検出は一般的でした:ポリスチレン43.6%、ポリエチレン71.8%、ポリ塩化ビニル(PVC)95.4%、ポリアミド66 61.8%。主要な悪性心血管イベント(MACE)を経験した患者では、冠動脈PVC濃度が高かったことが観察されました。PVCレベルは、炎症性サイトカイン(IL-1β、IL-6、IL-18、TNF-α)と相関していました。回帰分析では、PVCとMACEの調整オッズ比が1.090(95% CI 1.032–1.1523, P = 0.002)であることが報告されました(研究単位は完全に標準化されていません)。特に、著者らはPVCの10単位増加がMACEのリスクを2.374倍(OR 2.374; 95% CI 1.366–4.128; P = 0.002)上昇させることを指摘しています。21人のMI患者の血液と血栓サンプルの追加分析では、冠動脈血栓中のPVCレベルが炎症マーカーと単核細胞/マクロファージ浸潤と相関することがわかりました。
– 小児におけるCPB(Wu et al.):CPB後、血液中のMNP濃度が有意に上昇しました(p < 0.0001)。ポリマーごとの増加は、ポリスチレン(p = 0.046)、ポリエチレン(p = 0.038)、ポリプロピレン(p < 0.0001)、PVC(p < 0.0001)、ポリアミド6(p = 0.027)で統計的に有意でした。CPB時間とMNP曝露は相関していました(r = 0.43, P = 0.047)。MNP曝露の増加は、白血球数(r = 0.52, P = 0.013)と好中球数(r = 0.46, P = 0.029)の増加と相関していました。LDIRはCPB後の粒子数が増加していることを確認しました(p = 0.015)。著者らは、主にプラスチックで構成されているCPB回路が、急性の血液MNP曝露の直接的なソースであると結論付けています。
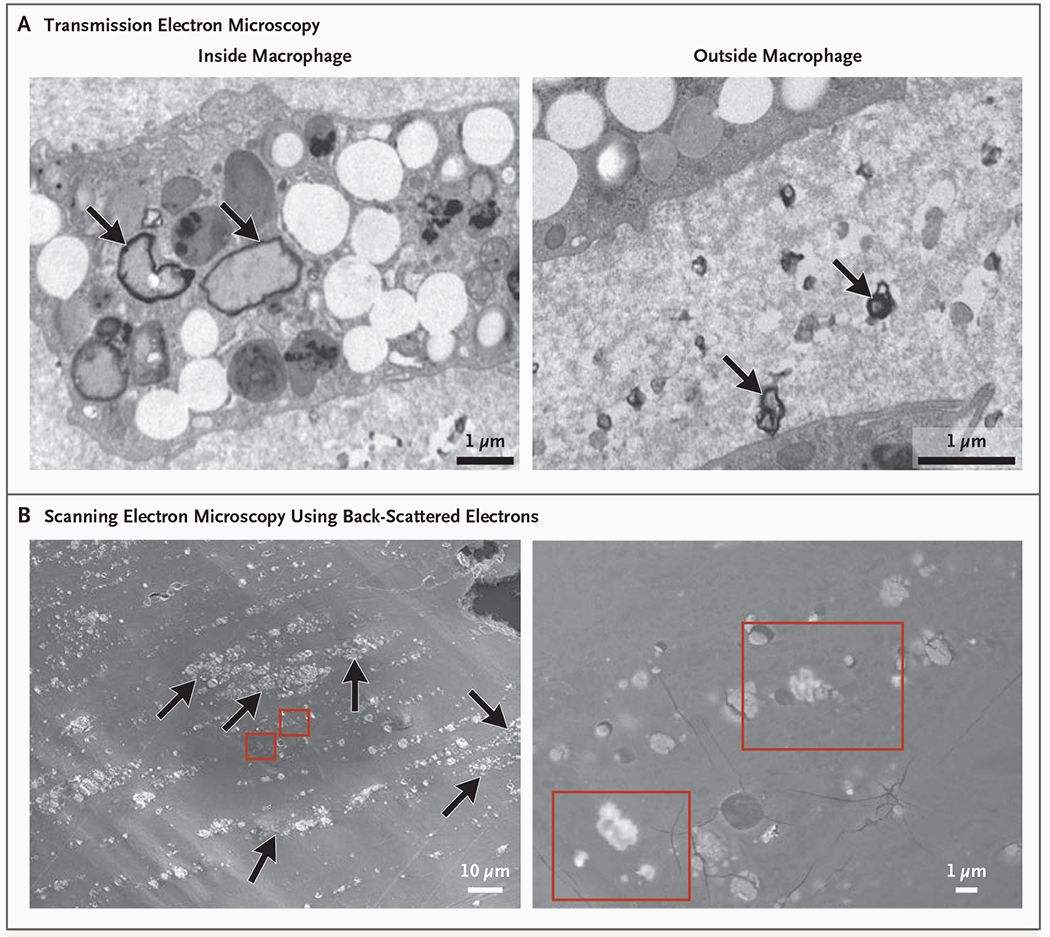
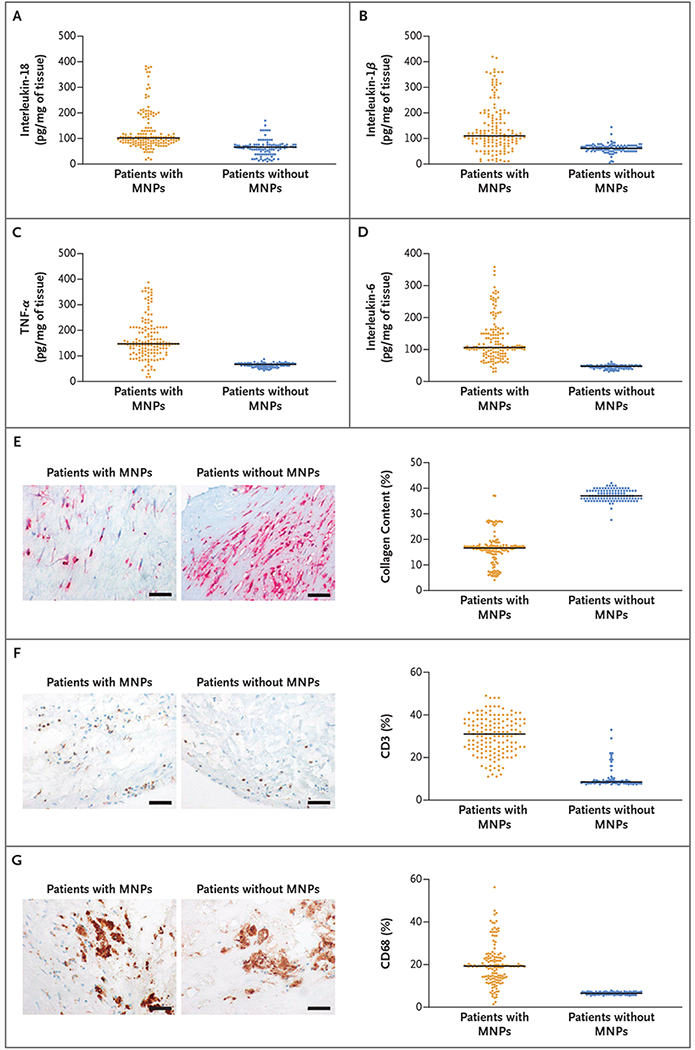
– アテローマと心血管イベント(Marfella et al.):257の評価可能なプラークのうち150個(58.4%)でポリエチレンが検出され、平均レベルは1 mgあたり21.7 ± 24.5 μgと報告されました。PVCは31人の患者(12.1%)で検出され、平均5.2 ± 2.4 μg/mgでした。電子顕微鏡では、プラークマクロファージ間に埋め込まれたギザギザの粒子が観察されました。放射線元素分析では、一部の粒子に塩素が検出されました(PVCと一致)。プラークにMNPが含まれる患者は、プラークにMNPが含まれない患者と比較して、主要エンドポイントの発生率が高かった(ハザード比 4.53; 95% CI 2.00–10.27; P < 0.001)。
Electron Microscopy Analysis of Atheromatous Plaque.
Inflammatory Markers in Plaque Samples.
比較解釈:全研究において、MNPは頻繁に検出され、炎症マーカーと悪性臨床アウトカム(頸動脈プラークとMIコホートで)との関連性が示されました。CPB研究は、急性の血管内MNP曝露の医原性経路と短期的な炎症反応の観察可能性を示しています。
専門家コメントと批判的評価
生物学的説明可能性:MNPと血管炎症の関連性は、粒子誘発酸化ストレス、内皮活性化、サイトカイン放出、免疫細胞募集を示すin vitroおよび動物データと一致しています。MNPは、広告された化学添加物(可塑剤、難燃剤)や微生物成分を運ぶことができ、炎症反応を増幅させる可能性があります。
方法論的強み:すべての3つの研究は前向きであり、Py-GC/MS、LDIR、電子顕微鏡などの現代的な分析技術を使用して、化学的特異性と、一部のケースでは組織内の視覚化された粒子局在を提供しています。頸動脈研究の多施設設計と臨床エンドポイントは、症候性イベントの外部妥当性を強化します。
主要な制限と代替説明:
– 汚染と分析の標準化:プラスチックは普遍的であり、厳密なブランクと手順制御が不可欠です。公開された研究は、汚染制御の報告とポリマー濃度単位の提示にばらつきがあり、研究間の比較が複雑になります。
– 測定と粒子特性:Py-GC/MSはポリマー質量と化学的シグネチャーを提供しますが、粒子サイズや形態を提供しません。顕微鏡は粒子を視覚化できますが、定量的なスループットと化学的特異性に制限があります。技術の組み合わせは進歩ですが、標準的なプロトコルはまだ普遍的に採用されていません。
– 観察的設計と混在:関連性は因果関係を証明しません。頸動脈研究では、プラークにMNPが含まれる患者は、測定されていない地理的、職業的露出、食事、社会経済的要因などで異なる可能性があります。既知のCVDリスク要因による残存混在の可能性が調整後も残ります。
– 一部の分析のサンプルサイズが小さい:CPB小児コホート(n=22)と血栓サブセット(n=21)は小さいため、結果は探索的とすべきです。
– 単位解釈と量反応:MI研究では、PVCとMACEの量的関連性が報告されていますが、測定単位と潜在的な非直線性の明確さが必要です。
臨床的意義:証拠は挑発的であり、理論的なリスクから、炎症と悪性アウトカムに関連する測定可能な人間の露出へと針を動かしています。しかし、因果関係を示したり、臨床的決定を下すための露出閾値を確立するには至っていません。現在のデータは、以下の2つの実用的な考慮事項を支持しています:(1)プラスチック製医療デバイス(例:CPB回路)からの急性医原性露出の可能性、(2)研究における系統的な汚染制御と、デバイスの生体適合性と粒子放出に関する規制上の注意。
結論と臨床的教訓
最近の人間の研究では、冠動脈血、CPB曝露血、頸動脈プラークからMNPが検出され、炎症と悪性心血管アウトカムとの関連性が報告されています。これらのデータは、事前臨床毒性学の合理的な人間の検証を提供し、CVDにおける見落とされていた環境的または医原性リスク要因としてMNPが作用する可能性を示唆しています。ただし、重要な注意点として、潜在的な汚染、分析方法の異質性、残存混在、観察的証拠の性質があります。臨床医はこれらの新興データに注意を払い、高品質な研究を支援し、侵襲的手順におけるプラスチック粒子放出を最小限に抑えるためにデバイスメーカーと規制当局と協力する必要があります。
研究アジェンダと政策優先事項
– サンプリング、ブランク制御、分析パイプライン(Py-GC/MS、微細FTIR、LDIR、電子顕微鏡の調和)を標準化し、比較可能性と量反応評価を可能にする。
– 基本的なMNP曝露評価と裁定された心血管アウトカムを持つ大規模な前向き人口コホートを設ける。
– 機序的人間研究(ex vivo血管組織曝露、倫理的に許容される制御注入モデル)と、粒子属性(サイズ、形状、化学)と免疫・内皮反応を結びつける翻訳研究を行う。
– 医療デバイス(CPB回路、カテーテル、透析)の放出を評価し、エンジニアリングソリューション(素材、コーティング、フィルター)と規制ガイドラインを用いて医原性曝露を減らす。
– 高曝露設定と脆弱な人口に対する公衆衛生監視と曝露軽減戦略を策定する。
参考文献
Zhang Y, Gao Q, Gao Q, Xu M, Fang N, Mu L, Han X, Yu H, Zhang S, Li Y, Gong Y. Microplastics and nanoplastics increase major adverse cardiac events in patients with myocardial infarction. J Hazard Mater. 2025 Jun 5;489:137624. doi: 10.1016/j.jhazmat.2025.137624 IF: 11.3 Q1 . Epub 2025 Feb 19. PMID: 40007360.
Marfella R, Prattichizzo F, Sardu C, Fulgenzi G, Graciotti L, Spadoni T, D’Onofrio N, Scisciola L, La Grotta R, Frigé C, Pellegrini V, Municinò M, Siniscalchi M, Spinetti F, Vigliotti G, Vecchione C, Carrizzo A, Accarino G, Squillante A, Spaziano G, Mirra D, Esposito R, Altieri S, Falco G, Fenti A, Galoppo S, Canzano S, Sasso FC, Matacchione G, Olivieri F, Ferraraccio F, Panarese I, Paolisso P, Barbato E, Lubritto C, Balestrieri ML, Mauro C, Caballero AE, Rajagopalan S, Ceriello A, D’Agostino B, Iovino P, Paolisso G. Microplastics and Nanoplastics in Atheromas and Cardiovascular Events. N Engl J Med. 2024 Mar 7;390(10):900-910. doi: 10.1056/NEJMoa2309822 IF: 78.5 Q1 . PMID: 38446676; PMCID: PMC11009876.
Wu Y, Chen Y, He R, Zhao T, Chen Z. Micronanoplastic exposure due to cardiopulmonary bypass in children: A prospective observational study. J Hazard Mater. 2025 Jun 5;489:137732. doi: 10.1016/j.jhazmat.2025.137732 IF: 11.3 Q1 . Epub 2025 Feb 23. PMID: 40010211.