背景
肿瘤免疫疗法作为癌症治疗的关键进展,通过利用免疫系统机制以更高的特异性靶向恶性细胞。然而,肿瘤微环境(TME)——其特征包括酸性、高还原电位和异常能量代谢等异质生理条件——对有效的免疫监视和治疗构成了重大障碍。主要挑战包括由TME诱导的免疫抑制介导的免疫逃逸以及肿瘤细胞中如Warburg效应等改变的代谢状态,这些都会降低治疗反应性。
此外,环鸟苷酸-腺苷酸合成酶(cGAS)-干扰素基因刺激因子(STING)通路被认为是一种重要的先天免疫机制,能够通过I型干扰素和促炎细胞因子的产生启动抗肿瘤免疫。尽管锰离子(Mn2+)最近被确定为cGAS-STING信号级联的强效激活剂和免疫细胞活化的促进者,但其临床疗效受到非特异性分布和潜在全身毒性的限制。
因此,需要策略来实现Mn2+的靶向递送,同时调节肿瘤代谢和TME以增强免疫治疗。
研究设计
本研究介绍了一种新型纳米平台LT@MnO@MON-HA (LMMH),该平台经过工程设计,能够响应肿瘤微环境,实现锰离子(Mn2+)和线粒体糖酵解抑制剂洛尼达明(LT)的控制释放。方法包括:
– 合成包裹在含有二硫键的有机介孔二氧化硅(MON)壳中的二氧化锰(MnO)纳米颗粒,使谷胱甘肽(GSH)响应降解。
– 将线粒体靶向洛尼达明(LT)封装在介孔内,然后用透明质酸(HA)表面涂层,通过CD44受体亲和力实现肿瘤特异性靶向。
– 全面的理化表征,包括透射电子显微镜、动态光散射、Zeta电位测量以及评估类芬顿催化活性和在模拟TME条件下药物释放的体外实验。
– 评估4T1肿瘤细胞内的ROS生成、糖酵解和磷酸戊糖途径的代谢干扰。
– 通过Western印迹、qRT-PCR和细胞因子ELISA评估骨髓来源树突状细胞中的cGAS-STING通路激活。
– 通过双侧4T1荷瘤小鼠模型探索体内疗效,详细评估肿瘤生长、免疫细胞浸润、细胞因子谱型和毒性分析。
统计分析涉及ANOVA和t检验比较,确保数据解释的严谨性。
主要发现
纳米平台表征和肿瘤微环境响应性
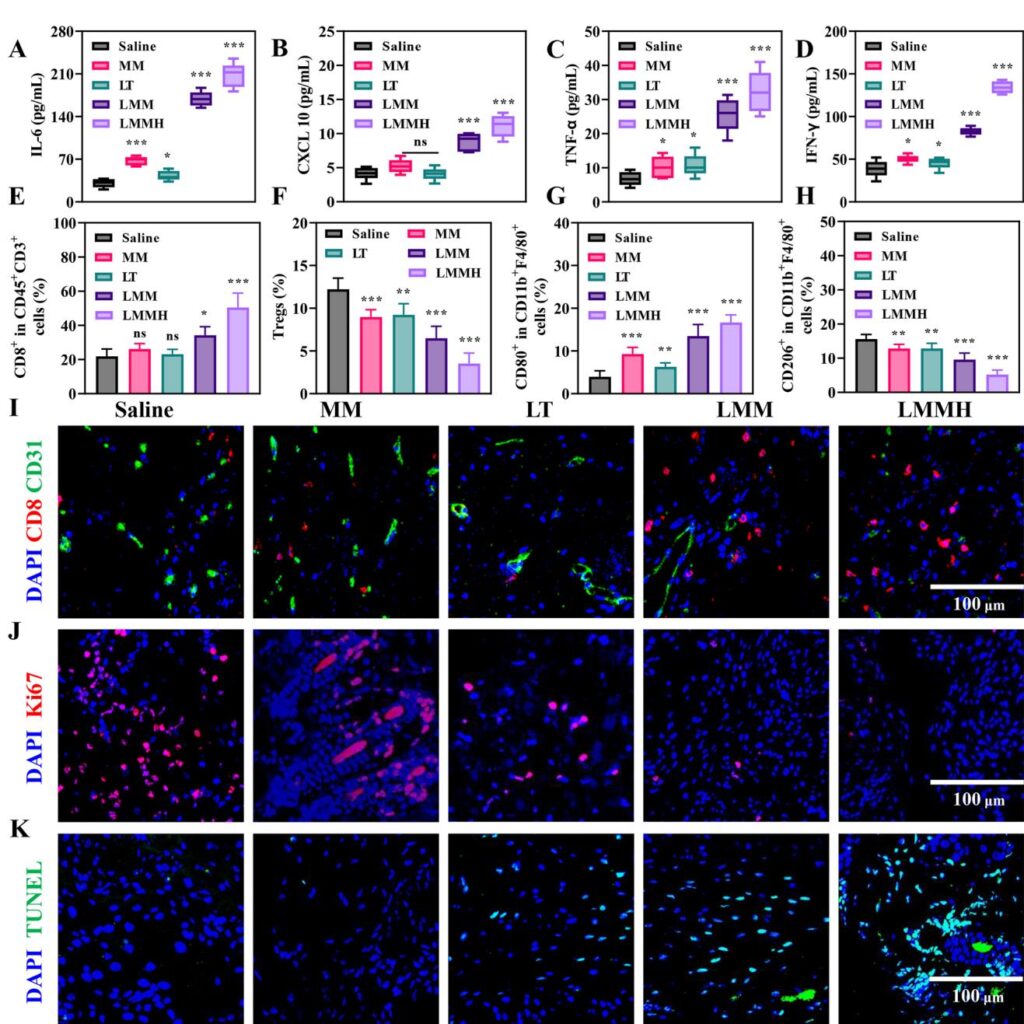
合成的LMMH纳米平台表现出独特的核壳结构,核心为二氧化锰纳米颗粒,外壳为含有GSH响应二硫键的介孔二氧化硅。TEM和元素映射证实了二氧化锰在二氧化硅基质中的封装。LMMH在生理条件下一周内表现出胶体稳定性,并且在酸性和GSH触发下释放Mn2+离子和LT,HA涂层提供了持续释放和增强的肿瘤靶向能力。体外实验表明,LMMH通过类芬顿反应催化内源性H2O2转化为高度活性的羟基自由基(·OH),实现有效的化学动力学治疗(CDT)。值得注意的是,LMMH在还原条件下有效消耗GSH,进一步加剧了肿瘤细胞的氧化应激。
代谢抑制和增强的ROS生成
LMMH中包含的LT靶向线粒体,干扰肿瘤糖酵解和磷酸戊糖途径,如减少葡萄糖-6-磷酸和乳酸水平,增加NADP+/NADPH比值,这在处理后的4T1细胞中得到证实。这种代谢干扰放大了细胞内ROS水平,并与Mn2+催化的·OH生成协同作用,通过氧化应激机制导致肿瘤细胞凋亡增加。这些效果优于单独使用游离LT或MnO配方,突显了纳米制剂在药物递送和生物活性方面的增强。
cGAS-STING通路的强效激活和免疫原性细胞死亡(ICD)
LMMH在树突状细胞中有效激活cGAS-STING通路,表现为STING和IRF3磷酸化的增加,以及I型干扰素(IFN-β)、促炎细胞因子(IL-6、TNF-α)和趋化因子(CXCL10、CCL5)的表达和分泌增加。这种免疫激活在肿瘤细胞中诱导强烈的免疫原性细胞死亡特征,包括钙网蛋白表面暴露增加、HMGB1释放和ATP分泌,这些有助于抗原呈递并刺激T细胞介导的适应性免疫。
体内治疗效果和免疫调节
在双侧小鼠4T1乳腺癌模型中,LMMH显著抑制原发和远处肿瘤生长,肿瘤抑制率超过90%,优于游离LT、MnO@MON (MM) 或其未组合的对应物。LMMH处理的肿瘤显示出细胞毒性CD8+ T细胞浸润增加、M1巨噬细胞极化升高以及调节性T细胞和M2样巨噬细胞减少,共同重塑免疫抑制的TME。相应地,肿瘤内抗肿瘤细胞因子IL-6、CXCL10、TNF-α和IFN-γ的水平显著升高。此外,免疫荧光显示血管生成和增殖标志物的局灶性抑制以及肿瘤细胞凋亡的增强。重要的是,纳米平台表现出良好的安全性,未观察到显著的全身毒性和器官损伤。
专家评论
LMMH纳米平台代表了纳米技术、免疫学和肿瘤代谢调节的优雅整合。通过结合线粒体代谢干扰和靶向Mn2+介导的cGAS-STING激活,这一策略克服了由敌对TME带来的关键障碍。GSH响应的二氧化硅壳在调节释放动力学和放大氧化应激方面具有优势。这种双重治疗机制——代谢干扰和先天免疫刺激——可以协同作用打破肿瘤免疫逃逸,增强系统性抗肿瘤免疫,包括远处转移的控制。
然而,要将其转化为临床应用,需要解决纳米材料合成的复杂性和可扩展性、药代动力学和长期安全性问题。基于锰的试剂的生物分布和潜在脱靶效应值得进一步阐明。此外,可以探索将LMMH与检查点抑制剂或其他免疫调节剂结合以进一步增强疗效。未来的研究应考虑不同的肿瘤模型和免疫微环境,以验证其普遍性。总体而言,这种方法在推进免疫-代谢联合癌症治疗方面具有前景。
结论
响应肿瘤微环境的Mn基纳米平台LT@MnO@MON-HA (LMMH) 通过线粒体靶向实现代谢抑制,并通过cGAS-STING通路刺激实现先天免疫激活,有效结合化学动力学治疗和免疫治疗,协同作用在临床前模型中强有力地抑制肿瘤生长和转移。该设计利用TME特有的触发因素如酸性和还原电位实现精确载荷释放,最小化全身毒性。代谢干扰增强了氧化应激,使肿瘤细胞对免疫介导的杀伤更加敏感,而Mn2+离子则促进细胞因子的产生和免疫细胞的活化。这一先进的纳米平台为下一代联合免疫疗法提供了一条有希望的途径,解决了肿瘤异质性和免疫逃逸带来的关键障碍。临床转化工作应集中在优化合成工艺并在不同肿瘤环境中验证安全性。总之,LMMH展示了通过整合肿瘤代谢调节和先天免疫通路参与来改善癌症患者预后的治疗潜力。
参考文献
Wen E, Tian Y, Chen Y, Wang Z, Feng Y, Liao Z. Tumor microenvironment responsive Mn-based nanoplatform activate cGAS-STING pathway combined with metabolic interference for enhanced anti-tumor therapy. J Nanobiotechnology. 2025 May 25;23(1):377. doi: 10.1186/s12951-025-03453-4 IF: 12.6 Q1 . PMID: 40414874 IF: 12.6 Q1 ; PMCID: PMC12105397 IF: 12.6 Q1 .