ハイライト
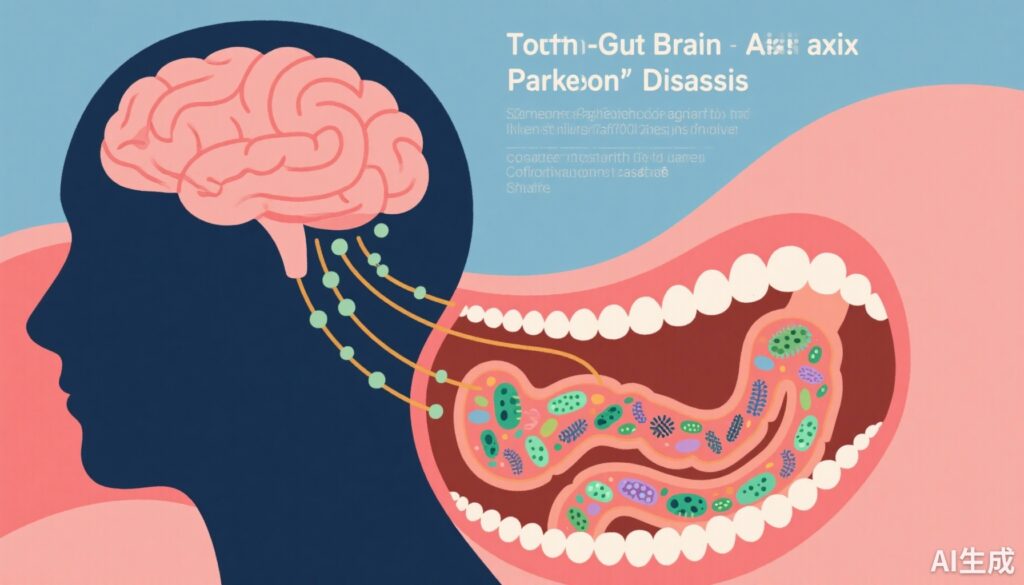
– 口腔および腸内微生物叢の病原性因子は、パーキンソン病(PD)における認知機能障害の進行と関連している。
– 口腔-腸間の移行は病原性を増加させ、宿主免疫と脳血管内皮機能を乱す。
– ショットガンメタゲノミクスと唾液メタプロテオミクスの統合により、軽度認知機能障害(PD-MCI)と認知症(PDD)における微生物機能異常が明らかになった。
– 知見は、神経変性疾患におけるバイオマーカーと治療介入の有望な標的として、口腔-腸-脳軸を支持している。
研究背景と疾患負担
パーキンソン病(PD)は世界中で1,000万人以上に影響を与え、主に運動症状を特徴とする主要な神経変性疾患である。しかし、非運動症状、特に認知機能障害(CI)は、疾患進行の過程で大多数のPD患者に見られ、軽度認知機能障害(PD-MCI)から認知症(PDD)まで広がっている。PDにおけるCI発症の病態生理学的メカニズムは未だ完全には理解されておらず、早期診断や対象的な介入に大きな課題をもたらしている。
ヒト微生物叢は、腸-脳軸を通じて神経学的健康に重要な影響を与える要因として注目されている。腸内細菌叢の神経変性疾患への役割は広く研究されてきたが、口腔内細菌叢とその腸内細菌叢との相互作用、すなわち口腔-腸親和性は比較的見過ごされてきた。口腔腔は、腸へ移行可能な微生物の重要な貯蔵庫であり、不均衡が全身炎症、免疫異常、血脳バリア(BBB)機能不全を引き起こし、神経変性と認知機能低下に寄与する可能性がある。したがって、口腔-腸-脳軸の探索は、PDにおけるCIを駆動するメカニズムの新しい視点を提供し、バイオマーカーの発見と治療標的の特定における新たな機会を示している。
研究デザイン
Clasenらによる本研究では、認知状態(PD-MCIとPDD)に分類されたPD患者と健常対照群から採取された228件のショットガンメタゲノミクスサンプル(腸と口腔の微生物叢)を用いて、包括的な多オミックスアプローチが採られた。口腔と腸の微生物コミュニティは、系統構成、機能遺伝子経路、病原性シグネチャーの観点から特徴付けられた。同時に、唾液メタプロテオミクスが統合され、微生物蛋白質の表現とその宿主免疫および脳血管内皮細胞機能への影響が評価された。
研究デザインは、認知機能障害スペクトラムの各段階での比較を可能とし、疾患進行に相関する微生物変化を特定するために使用された。主な研究エンドポイントには、PDに関連する認知機能低下と関連する微生物種、病原性因子、異常代謝経路、および宿主-微生物叢相互作用の特徴の同定が含まれた。
主要な知見
微生物叢の構成と病原性因子:PD患者と対照群の間で、特に認知機能障害のある患者で、口腔および腸内微生物叢に明確な違いが観察された。潜在的な病原性を持つ微生物種(パスボイント)は、PD-MCIで有意に富集しており、PDD患者ではさらにその傾向が強かった。特に、いくつかの口腔由来の微生物が腸内で増加していたことが確認され、口腔-腸間の移行が病原性を高めるメカニズムであることが示唆された。
接着分子、毒素、免疫回避タンパク質などの病原性因子は、認知機能低下の重症度と相関して増加していた。これは、単なる不均衡を超えて、微生物の病原性がPDの病態形成に積極的に寄与することを示唆している。
機能的異常:炭水化物代謝、アミノ酸代謝、神経活性化合物合成に関連する異常代謝経路が、腸と口腔の両方の微生物叢で同定され、PDDではより著しい変化が見られた。これらの経路は、神経炎症と神経変性プロセスに影響を与える可能性がある。
宿主-微生物叢の相互作用:唾液メタプロテオミクスの統合により、微生物病原性シグネチャーの上昇と、免疫機能障害と血脳バリア内皮細胞機能不全を示す宿主タンパク質変化が一致することが明らかになった。これは、口腔-腸微生物が直接脳血管内皮細胞に影響を与え、血管透過性を促進し、PD認知機能低下に関与する神経炎症カスケードを引き起こす可能性があることを示唆している。
また、本研究で提案された口腔-腸-脳軸モデルは、口腔パスボイントが腸に移行し、微生物生態系と病原性を変化させ、宿主の全身および神経環境に影響を与える動的な相互作用を強調している。
専門家コメント
本研究は、従来の腸-脳軸に焦点を当てることから、口腔微生物叢と口腔-腸間の移行経路を含むことで、PDに関連する認知機能低下の理解に重要な進展をもたらしている。多オミックスの統合は、微生物病原性因子が免疫異常と内皮細胞の機能不全を通じて、神経変性とCI発症に機械的に寄与することの生物学的妥当性を強化している。これらの知見は、微生物叢の関与が受動的であるという概念に挑戦し、標的抗生物質または微生物叢調整戦略が疾患進行を変える可能性を示唆している。
制限点には、因果関係を推論できない観察研究設計と、抗PD薬、食事、口腔衛生による潜在的な混雑要因が含まれる。今後、長期コホート研究と機械的実験モデルが必要となり、これらの知見を検証し、因果関係を解明し、バイオマーカー候補を臨床実践に翻訳する必要がある。
結論
要約すると、口腔と腸内微生物叢は、特に病原性因子の表現増加と口腔-腸間の微生物移行を通じて、パーキンソン病における神経変性プロセスの重要な構成要素であり、認知機能低下に影響を与えている。本研究は、パーキンソン病の病態生理学の解明、認知機能障害の早期バイオマーカーの開発、微生物叢を標的とした治療法の設計における、口腔-腸-脳軸の有望なフロンティアを強調している。医師は、パーキンソン病の非運動症状に対する多面的な微生物叢の貢献に注意し、継続的な研究では、パーキンソン病の管理において口腔健康と微生物叢の評価を統合すべきである。
参考文献
- Clasen F, Yildirim S, Arıkan M, et al. Microbiome signatures of virulence in the oral-gut-brain axis influence Parkinson’s disease and cognitive decline pathophysiology. Gut Microbes. 2025 Dec;17(1):2506843. doi: 10.1080/19490976.2025.2506843.
- Braak H, Del Tredici K. Neuroanatomy and pathology of sporadic Parkinson’s disease. Adv Anat Embryol Cell Biol. 2009;201:1-119.
- Mulak A, Bonaz B. Brain-gut-microbiota axis in Parkinson’s disease. World J Gastroenterol. 2015 Aug 14;21(37):10609-20.
- Heintz-Buschart A, Wilmes P. Human gut microbiome: function matters. Trends Microbiol. 2018 Jul;26(7):563-574.
- Needham BD, Trent MS. Fortifying the barrier: the impact of lipopolysaccharide modification on bacterial pathogenesis. Nat Rev Microbiol. 2013 Jul;11(7):467-81.