ハイライト
このランダム化臨床試験では、多モード磁気共鳴画像(MRI)と白質軌跡描出を用いた標的定義と、中程度の低分割同時ブースト強度変調放射線治療(HSIB-IMRT)を組み合わせた新しい放射線治療法を高グレードグリオーマ(HGG)に評価しました。本研究では、この技術が進行無生存期間(PFS)、全生存期間(OS)を損なうことなく、臨床標的体積を大幅に削減し、照射範囲外での再発を増加させないことが示されました。安全性プロファイルは標準治療と同等であり、個別化された体積節約型放射線治療がHGG管理における神経毒性を軽減する可能性を示唆しています。
研究背景と疾患負荷
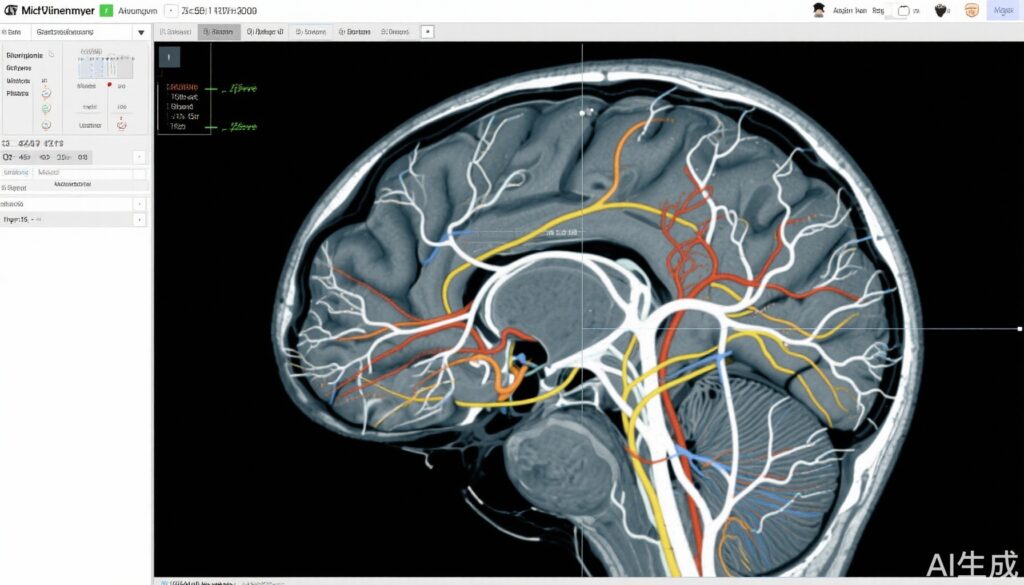
高グレードグリオーマ(HGG)、特にグリオブラストオーマと異型グリオーマは、最も攻撃性が高く致死的な原発性脳腫瘍の一つです。最大限の安全な手術切除、放射線治療、テモゾロミド化学療法を組み合わせた多モード治療を行っても、中央値生存期間は2年を超えることは稀です。放射線治療は管理の中心的な役割を果たしていますが、最適な照射標的体積と投与スケジュールは依然として活発な研究対象です。従来は、微視的腫瘍浸潤領域をカバーするために広範な臨床標的体積(CTV)が設定され、健康な脳組織への曝露と神経毒性のリスクが高まることがしばしばありました。神経画像診断の進歩により、多モードMRIや拡散テンソル画像による白質軌跡描出が腫瘍拡大経路をより正確にマッピングすることが可能になり、選択的な放射線治療標的定義が可能になりました。
さらに、分割スケジュールは効果と毒性に重要な影響を与えます。中程度の低分割放射線治療は、やや大きな単回投与量を用いて同時ブースト技術を行うことで、腫瘍制御を改善しつつ追加の毒性を引き起こさない可能性があります。したがって、照射体積と分割スケジュールの両方を精緻化して、HGG患者の臨床成績と生活品質を向上させる未充足のニーズがあります。
研究デザイン
本研究は、中国の医療センターで実施された単施設、前向き、オープンラベル、ランダム化臨床試験です。2018年1月から2022年8月にかけて、18歳から70歳までの新規診断高グレードグリオーマ患者154人が登録され、2024年6月までフォローアップが完了しました。
患者は以下の2つのアームに無作為に割り付けられました:
- 実験群:標的定義は、造影強化T1重み付けMRI、T2/FLAIRシーケンスなどの多モードMRI技術と、白質軌跡描出を統合して腫瘍浸潤経路を特定することで行われました。これに、高リスク領域に対する高用量ブーストを用いた中程度の低分割同時ブースト強度変調放射線治療(HSIB-IMRT)を組み合わせ、総合的な標的体積を削減しながら高リスク領域に高用量を投与しました。
- 標準群:患者は、既存ガイドラインに基づく確立された臨床標的体積を用いた標準的な強度変調放射線治療(IMRT)を受け、先進的な画像診断ガイドによる修正は行われませんでした。
両群とも、放射線治療中にテモゾロミド化学療法を併用し、その後も補助的にテモゾロミドを投与しました(Stuppプロトコルに基づく)。
主要評価項目は、進行無生存期間(PFS)で、無作為化から病勢進行または死亡までの時間を定義しました。副次評価項目には全生存期間(OS)と安全性(治療関連有害事象に焦点を当て)が含まれました。
主要な知見
154人の登録患者の中央値フォローアップ期間は22ヶ月(範囲4~76ヶ月)、研究終了時点で96件の死亡が観察されました。基準特性(中央値年齢51.5歳、男性55.2%)は両群間で同等でした。
進行無生存期間:実験群の中央値PFSは15.5ヶ月(95%信頼区間11.7~19.3ヶ月)、標準群は13.5ヶ月(95%信頼区間8.7~18.3ヶ月)で、統計学的に有意な差は見られませんでした(P = .89)。
全生存期間:実験群の中央値OSは27.0ヶ月(95%信頼区間13.9~40.1ヶ月)、標準群は21.0ヶ月(95%信頼区間18.0~24.0ヶ月)でした。この差は統計学的に有意ではありませんでしたが(P = .24)、数値的には実験群が優れていました。
臨床標的体積:実験群の中央値CTVは、標準群よりも著しく小さかったです(CTV1中央値116.7 cm3 vs 225.0 cm3、P < .001;CTV2中央値174.4 cm3)。照射脳体積の減少は、放射線関連神経毒性の軽減につながる可能性があります。
再発パターン:照射標的体積内、外、または多中心的な腫瘍再発率は両群間で同等であり、先進的な画像診断によるCTV縮小が境界外や照射範囲外の失敗リスクを増加させないことを示しています。
安全性:3級または4級の治療関連有害事象は、実験群で5.3%、標準群で3.8%(P = .72)の患者に認められ、耐容性は同等でした。
専門家のコメント
この試験は、HGGに対する個別化放射線治療の重要な進歩を示しています。多モードMRIと白質軌跡描出を用いた標的定義は、潜在的な腫瘍拡大経路を特定するための解剖学的精度を向上させ、従来の大きなマージン概念に挑戦します。中程度の低分割同時ブーストIMRTは、高リスク腫瘍領域内の個別化された用量上昇を提供し、理論的には腫瘍制御を改善します。
主要評価項目であるPFSとOSに統計学的に有意な差は見られませんでしたが、実験群は照射体積を大幅に削減しつつ、同等の腫瘍学的成績を達成しました。これは、神経認知機能の低下や放射線誘発性毒性の軽減という長期的な臨床的恩恵につながる可能性があります。
制限点としては、単施設設定と比較的小規模なサンプルサイズがあり、一般化の限界があります。今後の多施設研究でより大規模なコホートと長期フォローアップを行い、これらの結果を確認し、神経認知機能と生活品質の評価項目を検討する必要があります。また、画像バイオマーカーの継続的な進歩により、個別化された標的定義がさらに洗練される可能性があります。
結論
多モードMRIと白質軌跡描出を用いた標的定義と中程度の低分割同時ブーストIMRTの組み合わせは、新規診断高グレードグリオーマの治療に有望な戦略です。生存期間を損なうことなく、臨床標的体積を大幅に削減し、再発リスクを増加させないことで、より個別化された体積節約型放射線治療プロトコルへの移行を支持します。このような革新は、最終的には、この深刻な疾患を持つ患者の長期的な機能的成績と生活品質を向上させる可能性があります。
これらの知見は、将来の臨床試験設計やHGG管理の最適化を目指す放射線腫瘍学ガイドラインへの取り組みを促進するものです。
参考文献
- Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-996. doi:10.1056/NEJMoa043330
- Weller M, van den Bent M, Tonn JC, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2021;18(3):170-186. doi:10.1038/s41571-020-00447-z
- Alexander BM, Ba S, Sampson JH, et al. Tumor treatment fields in malignant gliomas: past, present, and future. Neuro Oncol. 2020;22(2):190-199. doi:10.1093/neuonc/noz161
- Yang W, Yan Q, Zhang A, et al. Modified Target Delineation and Moderately Hypofractionated Radiotherapy for High-Grade Glioma: A Randomized Clinical Trial. JAMA Netw Open. 2025;8(7):e2523053. doi:10.1001/jamanetworkopen.2025.23053