ハイライト
- PreCePra第3相試験は、fMRIで高中枢神経系疼痛活性化が関節リウマチ(RA)に対するTNF阻害の臨床反応を予測することを示しました。
- 疾患に関連した脳活性化が高い患者は、セトルズマブペゴル治療開始後12週間で低疾患活動性を達成する割合が有意に高かったです。
- 本研究は、RAの生物学的療法を導く潜在的な客観的バイオマーカーを提供し、主観的な反応指標の課題に対処します。
臨床背景と疾患負荷
関節リウマチ(RA)は、主に滑膜関節に影響を与え、痛み、腫れ、最終的には制御不足により関節破壊を引き起こす慢性の全身性自己免疫疾患です。TNF阻害剤は、従来の合成型疾患修飾抗リウマチ薬(csDMARDs)に十分に反応しない中等度から重度のRA患者の治療の中心的役割を果たしています。しかし、約40〜50%の患者がTNF阻害剤に有意な反応を示さず、治療成功の信頼できる予測因子は未だ不明です。現在の複合反応基準が主観的な患者報告結果(疼痛や全体的な疾患活動性など)を組み込むことにより、客観的な反応予測因子の特定がさらに複雑化しています。
研究方法論
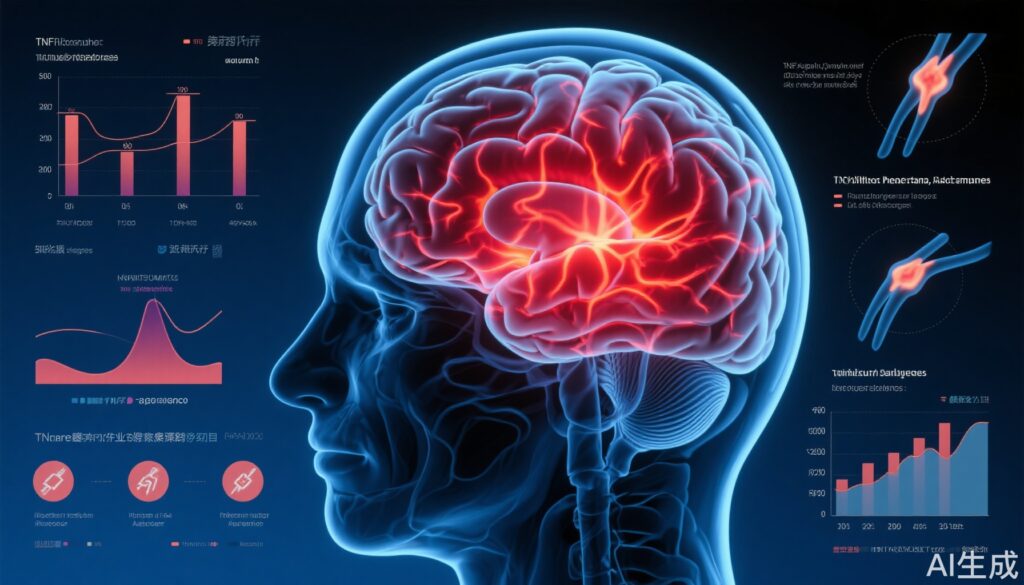
PreCePra研究は、ドイツ、ポルトガル、セルビアの6つのリウマチセンターで実施された第3相、多施設、二重盲検、プラセボ対照、並行群間無作為化臨床試験でした。18歳以上の成人で、少なくとも1つのcsDMARDにもかかわらず持続的な疾患活動性が認められる活動性RA患者が対象でした。ベースラインでは、すべての参加者が機能的MRI(fMRI)脳スキャンを受け、中枢感作またはRA関連疾患の脳表現の代理指標としてCNS疼痛活性化を評価しました。
fMRIの結果に基づいて、患者は高または低CNS活性化グループに分類され、2:1の比率でセトルズマブペゴル(0、2、4週目に400 mg皮下投与、その後24週間まで隔週200 mg)またはプラセボに無作為に割り付けられました。患者と医師の両方がグループ割り付けを盲検化していました。主要エンドポイントは、12週目での低疾患活動性(28関節の疾患活動性スコア [DAS28] ≤3.2)を達成した患者の割合で、ITT原則に基づいて分析されました。
主要な知見
148人のスクリーニング患者のうち、139人が無作為化されました:高容量セトルズマブペゴル群49人、低容量セトルズマブペゴル群43人、プラセボ群47人。研究対象者は女性が大多数(71%)でした。12週目での低疾患活動性(DAS28 ≤3.2)を達成した患者の割合は以下の通りでした:
- 高容量セトルズマブペゴル群:49人中28人(57%)
- 低容量セトルズマブペゴル群:43人中19人(44%)
- プラセボ群:47人中12人(26%)
高容量セトルズマブペゴル群の反応率はプラセボ群よりも有意に高く(p=0.0017)であったのに対し、低容量群とプラセボ群の差は統計的に有意ではありませんでした(p=0.063)。高容量群の治療が必要な数(NNT)はプラセボ群に対して約3.7であり、臨床上有意な効果サイズを示していました。
治療に関連する有害事象は、セトルズマブペゴル群の22人とプラセボ群の3人に報告され、予期せぬ安全性シグナルはありませんでした。
メカニズム的洞察や生物学的妥当性
本研究は、fMRIによって測定されるCNS疼痛処理が、RAの基礎疾患活動性や疼痛感作を反映しているという仮説に基づいています。疼痛関連領域での脳活性化が高い患者は、疾患の神経免疫成分がより顕著であり、TNF遮断に反応しやすい可能性があります。この客観的指標は、主観的な症状報告の混同効果を軽減しながら、TNF阻害剤に最も反応する患者を特定するための代理指標として機能する可能性があります。
専門家コメント
EULARやACRなどの最近の臨床ガイドラインでは、RAにおける精密医療アプローチの必要性が強調されており、生物学的療法の最適化を目指しています。予測ツールとしての機能的神経イメージングの使用は、この目標に向けて新しい一歩を表しています。しかし、専門家は、大規模で多様なコホートでの検証と他の臨床的、血清学的指標との統合が必要であると警告しています。
議論点や制限
いくつかの制限点について議論する必要があります:
- 研究の比較的小さなサンプルサイズと地理的な制限により、一般化可能性が制限される可能性があります。
- fMRIを予測ツールとして使用するコスト、可用性、標準化は、臨床への移行における大きな障壁となっています。
- 患者や生活経験の意見が研究デザインに含まれていませんでした。
- CNS活性化のメカニズムとTNF抑制によるその変調の詳細な解明が必要です。
- 少なくとも1つのcsDMARDに失敗した患者のみが対象であったため、スペクトラムバイアスの可能性があります。
結論
PreCePra第3相試験は、fMRIによって測定された疾患関連CNS疼痛活性化が、RAにおけるTNF阻害剤療法の臨床反応を予測することを示す強力な証拠を提供しました。この知見は、リウマチ学における客観的バイオマーカーの探索を進め、より個別化された治療戦略の希望を提供します。今後の研究では、これらの結果の検証、基礎メカニズムの明確化、神経イメージングを日常診療に組み込む可行性の評価が必要です。
参考文献
1. Hess A, Tascilar K, Schenker HM, Konerth L, Schönau V, Sergeeva M, et al. Disease-associated brain activation predicts clinical response to TNF inhibition in rheumatoid arthritis (PreCePra): a randomised, multicentre, double-blind, placebo-controlled phase 3 study. Lancet Rheumatol. 2025 Aug;7(8):e565-e575. doi: 10.1016/S2665-9913(25)00032-3 IF: 16.4 Q1 . PMID: 40570879 IF: 16.4 Q1 .2. Smolen JS, Landewé RBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2023 update. Ann Rheum Dis. 2023;82:3–18.3. Singh JA, Saag KG, Bridges SL Jr, et al. 2015 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Rheumatol. 2016;68(1):1-26.
00032-3/asset/9a86ddec-2d8f-4cf3-bec8-f217e5195855/main.assets/gr2.jpg)