ハイライト
- プロトンポンプ阻害剤(PPI)を搭載したマンガン硫化物(MS)ナノプラットフォームは、腫瘍酸性のリアルタイムMRI可視化を可能とします。
- このナノプラットフォームは、酸性の腫瘍リソソームでMn2+、H2S、PPIを放出し、腫瘍酸性を誘導し、MRIコントラストを向上させます。
- 腫瘍酸性は腫瘍縮小と正の相関があり、従来の構造的画像診断よりもはるかに早く治療効果を予測できます。
- ナノプラットフォームによって誘導された腫瘍酸性は、予想外に腫瘍転移を抑制することも明らかになり、治療効果の可能性が示されました。
研究背景と疾患負担
がんは世界中で主要な死亡原因であり、腫瘍の異質性は治療応答の迅速な評価に重要な課題となっています。従来の方法では、腫瘍の体積変化や解剖学的な変化を測定することが一般的ですが、これらの変化が現れるまでには長い時間がかかることがよくあります。この遅延により、病態進行前に治療計画を修正する機会が失われることがあります。さらに、腫瘍の酸性微環境は腫瘍の進行、侵襲性、治療抵抗性と関連していることが確立されています。プロトンポンプや代謝の変化が細胞外の酸性化を引き起こしますが、腫瘍酸性の非侵襲的なリアルタイム評価は技術的に困難です。したがって、腫瘍の酸性度を動的にマッピングし、治療効果の早期の洞察を提供できる革新的なアプローチの臨床的ニーズが未充足のままです。
研究デザイン
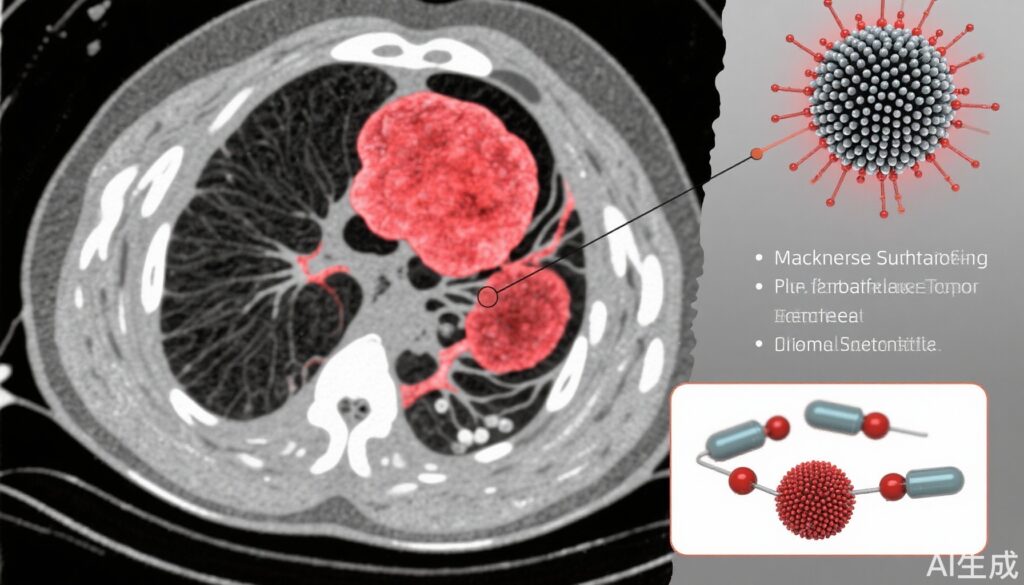
本研究では、がんの治療診断応用を目的として、プロトンポンプ阻害剤(PPI)を搭載したマンガン硫化物を基盤としたナノプラットフォーム(MSP)を設計しました。MSPの合成は、マンガンアセチルアセトネートとチオアセトアミドをエチレングリコール中に用いて2段階の化学法で行われ、直径約120 nmの球形マンガン硫化物ナノ粒子が得られました。ナノプラットフォームの物理化学的特性(形状、結晶性、表面化学、pH応答性分解)は、透過電子顕微鏡(TEM)、高解像度TEM、X線回折(XRD)、X線光電子分光(XPS)を用いて評価されました。
MSPから放出される機能成分(Mn2+、H2S、PPI)は、腫瘍リソソームの酸性環境を模擬するために異なるpH条件下で定量されました。H2Sの生成確認はAgNO3沈殿試験で行われ、Fenton反応によるMn2+触媒による活性酸素種の生成は比色法で評価されました。MRI緩和率(r1)測定は、MSPによるpH依存性MRI信号強度の増加を決定するために行われました。
さらに、MSPは、PPIの搭載量(10%、25%、44%)を変えて腫瘍酸性を調整し、その結果、腫瘍細胞リソソームのpH、グルコース代謝、乳酸生成への影響を評価しました。誘導された腫瘍酸性、ナノプラットフォームの分解、MRI信号強度との相関関係が系統的に分析されました。また、腫瘍酸性が腫瘍成長の退縮と転移の可能性に与える影響も調査されました。
主要な知見
合成されたマンガン硫化物ナノ粒子は、MnS (002) 面と一致する均一な球形の形態と高い結晶性を示しました。XPSはMn2+と硫化イオンの存在を確認し、成功した合成を支持しました。酸性条件での分解試験では、pH 4.5で最大の分解効率(79.5%)が示され、Mn2+、PPI、H2Sが放出されました。この分解は、気泡の形成と特徴的なH2S臭を伴い、黒色のAg2S沈殿がH2Sの生成を確認しました。
放出されたMn2+はFenton反応によりヒドロキシルラジカル(•OH)の生成を触媒し、脱色と比色法で確認され、抗腫瘍効果に寄与する可能性のある細胞毒性効果を示しました。特に、酸性条件下ではMRI緩和率(r1)が著しく上昇し、pH 4.5で最高の緩和率(8.243 mM−1 s−1)が示され、中性pHでは最低の緩和率(1.628 mM−1 s−1)が示されました。
異なるPPI搭載量を持つナノプラットフォームは、V-ATPaseポンプを阻害し、細胞内H+濃度を上昇させることで、段階的な腫瘍酸性を誘導しました。放出されたH2Sは腫瘍のグルコース消費を強化し、乳酸産生を増加させ、酸性を強化し、これが正のフィードバックループを形成してMSPの分解とMRI信号強度の上昇を加速しました。重要なのは、腫瘍酸性の程度が腫瘍退縮の指標と正の相関があるため、従来の構造的変化よりも前に治療効果をリアルタイムで予測できることです。
予想外に、腫瘍酸性の増加は転移の拡散を抑制し、追加の治療効果を提供しました。したがって、このナノプラットフォームは、腫瘍微環境の酸性度をモニタリングし、腫瘍生理学を調整することにより、診断と治療を橋渡しします。
専門家コメント
この革新的なマンガン硫化物を基盤としたナノプラットフォームは、腫瘍微環境のイメージングと治療モニタリングの分野において重要な進歩を代表しています。腫瘍酸性のリアルタイム、非侵襲的なMRIは、従来のサイズに基づく基準よりもはるかに早く腫瘍の代謝状態と治療応答を反映する動的なバイオマーカーを医師に提供します。
メカニズム的には、腫瘍リソソームの酸性化を利用して化合物の放出を誘発し、代謝のフィードバックループを形成することは、精密ナノメディシン設計の一例です。さらに、H2Sが腫瘍代謝を再構成し、Mn2+のFenton反応による細胞毒性ラジカルの生成が多様な治療効果をもたらすことを示しています。
制限点としては、包括的な体内検証、長期安全性プロファイリング、多様な腫瘍モデルでの評価が必要であり、一般化可能性を確認する必要があります。さらに、臨床応用への移行には、合成のスケーリングと規制経路のナビゲーションが必要です。ただし、単一のナノ構造内でpH応答性MRIコントラストと治療薬の放出を統合することは、リアルタイムのがん治療モニタリングと適応的な治療戦略を変革する可能性があります。
結論
プロトンポンプ阻害剤を搭載したマンガン硫化物ナノプラットフォームは、腫瘍酸性のリアルタイムMRI可視化を可能にする新しい治療診断ツールです。腫瘍リソソームの酸性度を利用して治療薬を放出し、MRI信号を向上させるこのプラットフォームは、治療効果の早期予測を可能とし、医師が介入を動的に調整できるようにします。MRIで測定された腫瘍酸性と腫瘍退縮の正の相関関係は、このアプローチの臨床的有用性を強調しています。さらに、観察された転移抑制は追加の治療効果を示しており、将来の臨床応用は、適時の診断フィードバックと標的代謝調節の統合により、がん管理の最適化につながる可能性があります。
参考文献
1. Gillies RJ, Robey I, Gatenby RA. Causes and consequences of increased glucose metabolism of cancers. J Nucl Med. 2008;49 Suppl 2:24S-42S.
2. Webb BA, Chimenti M, Jacobson MP, Barber DL. Dysregulated pH: a perfect storm for cancer progression. Nat Rev Cancer. 2011;11(9):671-677.
3. Li W, Fan W, Bu W, et al. Smart manganese oxide nanoagents for magnetic resonance imaging-guided photothermal therapy. Chem Sci. 2017;8(3):1193-1200.
4. Neri D, Supuran CT. Interfering with pH regulation in tumours as a therapeutic strategy. Nat Rev Drug Discov. 2011;10(10):767-777.
5. Chen Z, Zhao P, Luo Z, et al. Glutathione-responsive disulfide bond-containing polymeric prodrug nanoplatforms for simultaneous diagnosis and therapy of tumors. Biomaterials. 2015;73:149-162.
6. DeBerardinis RJ, Chandel NS. Fundamentals of cancer metabolism. Sci Adv. 2016;2(5):e1600200.
7. Murphy MP. Targeting lipophilic cations to mitochondria. Biochim Biophys Acta. 2008;1777(7-8):1028-1031.
8. Chen H, Zeng X, Ma Y, et al. Targeting tumor hypoxia and reactive oxygen species for effective photodynamic therapy. Chem Soc Rev. 2021;50(20):11933-11955.