背景
腫瘍免疫療法は、悪性細胞を標的とする免疫系のメカニズムを利用し、がん治療における重要な進歩となりました。しかし、酸性、還元ポテンシャルの上昇、異常なエネルギー代謝などの多様な生理学的状態を特徴とする腫瘍微環境(TME)は、有効な免疫監視と治療に大きな障壁をもたらしています。主な課題には、TMEによって誘導される免疫抑制や、腫瘍細胞のワールブルグ効果などの変化した代謝状態による治療反応性の低下が含まれます。
また、シクラックGMP-AMP合成酵素(cGAS)-インターフェロン遺伝子刺激因子(STING)経路は、I型インターフェロンやプロ炎症性サイトカインの産生を通じて抗腫瘍免疫を開始する重要な先天性免疫メカニズムとして認識されています。マンガンイオン(Mn2+)は最近、cGAS-STINGシグナル伝達経路の強力な活性化因子および免疫細胞活性化の促進因子として特定されましたが、非特異的な分布と潜在的な全身毒性により、臨床効果が阻害されています。
したがって、Mn2+の標的配達を可能にする戦略と、腫瘍代謝とTMEの調整を組み合わせて免疫療法を強化するための戦略が必要です。
研究デザイン
本研究では、腫瘍微環境に応答するLT@MnO@MON-HA(LMMH)という新しいナノプラットフォームを紹介します。このプラットフォームは、マンガンイオン(Mn2+)とミトコンドリア糖代謝阻害剤ロニダミン(LT)の制御放出を可能にしています。方法論は以下の通りです:
– マンガン酸化物(MnO)ナノ粒子を、グルタチオン(GSH)応答性分解を可能にする二硫化物結合を含む有機中孔シリカ(MON)シェルでカプセル化すること。
– ミトコンドリア標的のロニダミン(LT)を中孔にカプセル化し、CD44受容体親和性を用いた腫瘍特異的標的化のためにヒアルロン酸(HA)で表面コーティングすること。
– 透射電子顕微鏡、動的光散乱、ゼータ電位測定、TME模倣条件でのフェントン反応のような触媒活性と薬物放出を評価するためのin vitroアッセイを含む包括的な物理化学的特性評価。
– 4T1腫瘍細胞での細胞内ROS生成、糖代謝とペンタースリン酸経路への代謝干渉の評価。
– 骨髄由来樹状細胞におけるcGAS-STING経路の活性化をウェスタンブロッティング、qRT-PCR、サイトカインELISAで評価。
– 双側4T1腫瘍マウスモデルを用いたin vivo効果の探索。腫瘍成長評価、免疫細胞浸潤、サイトカインプロファイリング、毒性分析が行われました。
統計解析はANOVAとt検定比較を行い、データ解釈の厳密さを確保しました。
主要な知見
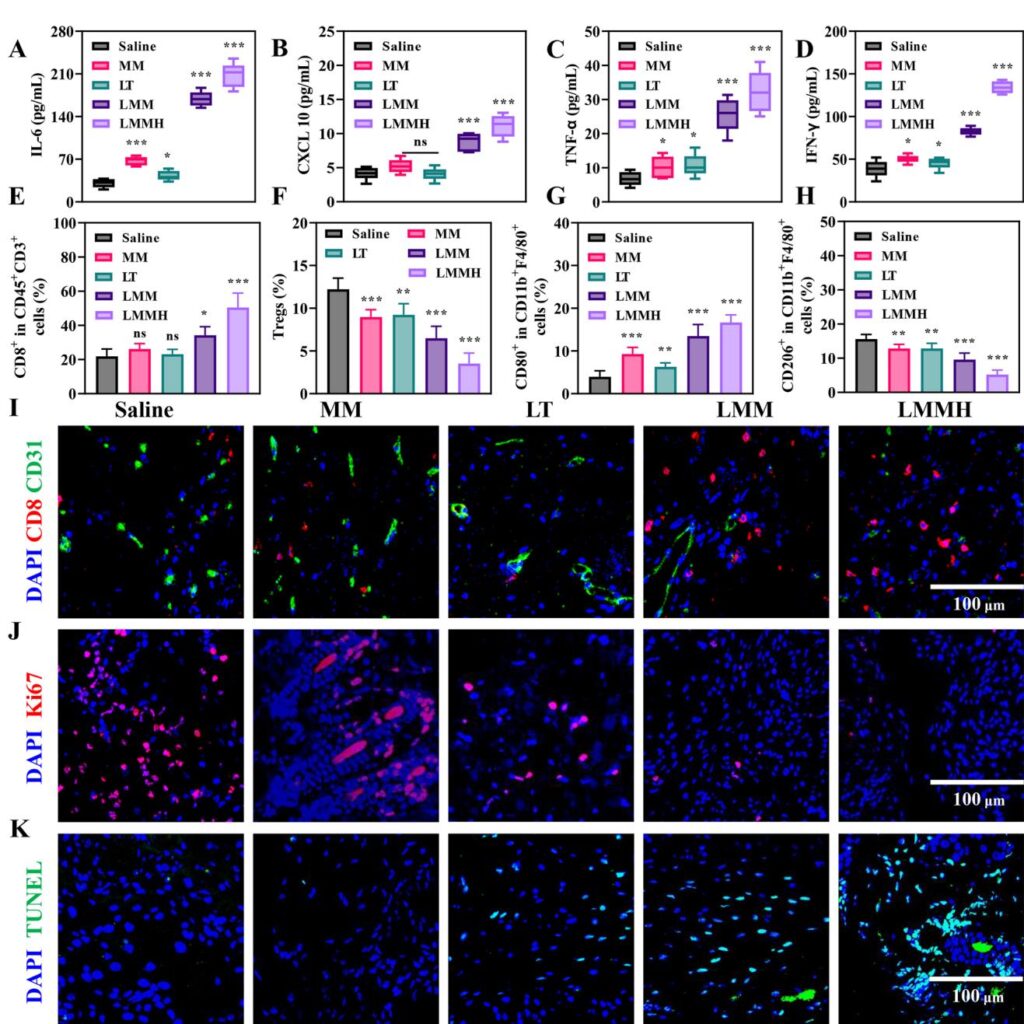
ナノプラットフォームの特性評価と腫瘍微環境応答性
合成されたLMMHナノプラットフォームは、マンガン酸化物(MnO)ナノ粒子が中孔シリカシェルに囲まれたコア-シェル構造を示しました。TEMと元素マッピングにより、マンガンのシリカマトリックス内封が確認されました。LMMHは生理条件下で1週間のコロイド安定性を示し、酸性およびGSH応答性放出によりMn2+イオンとLTを放出しました。HAコーティングにより持続放出と腫瘍標的性が向上しました。in vitroでは、LMMHが内因性H2O2をFenton反応によって高反応性のヒドロキシラジカル(・OH)に変換し、効果的な化学動力学療法(CDT)を実現しました。特に、LMMHは還元条件下でGSHを効率的に消費し、腫瘍細胞の酸化ストレスを促進しました。
代謝阻害とROS生成の増加
LMMHに組み込まれたLTは、ミトコンドリアを標的として腫瘍糖代謝とペンタースリン酸経路を阻害し、4T1細胞でのグルコース-6-リン酸と乳酸レベルの低下、NADP+/NADPH比の上昇が確認されました。この代謝干渉は、細胞内のROSレベルを増加させ、Mn2+触媒による・OH生成と相乗的に作用し、酸化ストレスによる腫瘍細胞アポトーシスを高めました。これらの効果は、自由なLTまたはMnOフォーミュレーション単独よりも優れており、ナノフォーミュレーションの薬物送達と生物学的活性の向上を示しています。
cGAS-STING経路の強力な活性化と免疫原性細胞死(ICD)
LMMHは樹状細胞においてcGAS-STING経路を効果的に活性化し、STINGとIRF3のリン酸化増加、I型インターフェロン(IFN-β)、プロ炎症性サイトカイン(IL-6、TNF-α)、ケモカイン(CXCL10、CCL5)の発現と分泌の増加が確認されました。この免疫活性化は、腫瘍細胞でのカルレチクリン表面露出、HMGB1放出、ATP分泌の増加といった強力な免疫原性細胞死の兆候を誘導し、抗原提示を促進し、T細胞を介した獲得免疫を刺激します。
in vivo治療効果と免疫調節
双側4T1乳がんマウスモデルにおいて、LMMHは主腫瘍と遠隔腫瘍の成長を著しく抑制し、腫瘍抑制率が90%以上となり、自由なLT、MnO@MON(MM)、またはそれらの未組合せのものよりも優れました。LMMH処理された腫瘍では、細胞障害性CD8+ T細胞の浸潤増加、M1マクロファージの極性化上昇、規制T細胞とM2様マクロファージの減少が観察され、免疫抑制的なTMEが再形成されました。対応して、腫瘍内の抗腫瘍サイトカインIL-6、CXCL10、TNF-α、IFN-γのレベルが有意に上昇しました。さらに、免疫蛍光では血管新生と増殖マーカーの局所抑制、腫瘍細胞アポトーシスの増加が確認されました。重要なことに、ナノプラットフォームは全身毒性や臓器損傷が認められない良好な安全性プロファイルを示しました。
専門家コメント
LMMHナノプラットフォームは、ナノテクノロジー、免疫学、腫瘍代謝調整のエレガントな統合を代表しています。ミトコンドリア代謝干渉と標的Mn2+媒介cGAS-STING活性化を組み合わせることで、敵対的なTMEによって課される重要な障壁を克服します。GSH応答性シリカシェルは、放出動態を調整し、酸化ストレスを増幅する点で有利です。この二重の治療メカニズム—代謝干渉と先天性免疫刺激—は、腫瘍免疫回避を打破し、全身の抗腫瘍免疫、特に遠隔転移制御を強化する可能性があります。
ただし、臨床使用への翻訳には、ナノ材料合成の複雑さとスケーラビリティ、薬物動態、長期安全性の問題に対処する必要があります。Mnを基盤とするエージェントの生体内分布と潜在的なオフターゲット効果についてもさらなる詳細が必要です。さらに、LMMHをチェックポイント阻害剤や他の免疫調節剤と組み合わせることで効果をさらに高める可能性を検討することができます。今後の研究では、多様な腫瘍モデルと免疫微小環境の一般化可能性を検証する必要があります。全体として、このアプローチは免疫-代謝組合せがん療法の進歩に貢献する可能性があります。
結論
腫瘍微環境応答性マンガンナノプラットフォームLT@MnO@MON-HA(LMMH)は、ミトコンドリア標的による代謝阻害とcGAS-STING経路刺激による先天性免疫活性化を介した化学動力学療法と免疫療法の相乗効果を促進し、前臨床モデルにおける腫瘍成長と転移の抑制を強力にサポートします。設計は、酸性と還元ポテンシャルなどのTME固有のトリガーを活用して、全身毒性を最小限に抑えながら精密な貨物放出を可能にします。代謝干渉は酸化ストレスを増強し、腫瘍細胞の免疫介在死を感作し、一方でMn2+イオンはサイトカイン産生と免疫細胞活性化を促進します。この先進的なナノプラットフォームは、次世代の組合せ免疫療法の有望な道筋を提供し、腫瘍の異質性と免疫回避に起因する重要な障壁に対処します。臨床翻訳努力は、合成プロトコルの最適化と多様な腫瘍状況での安全性検証に焦点を当てるべきです。全体として、LMMHは、腫瘍代謝調整と先天性免疫経路の関与を統合してがん患者の予後を改善する治療の可能性を示しています。