ハイライト
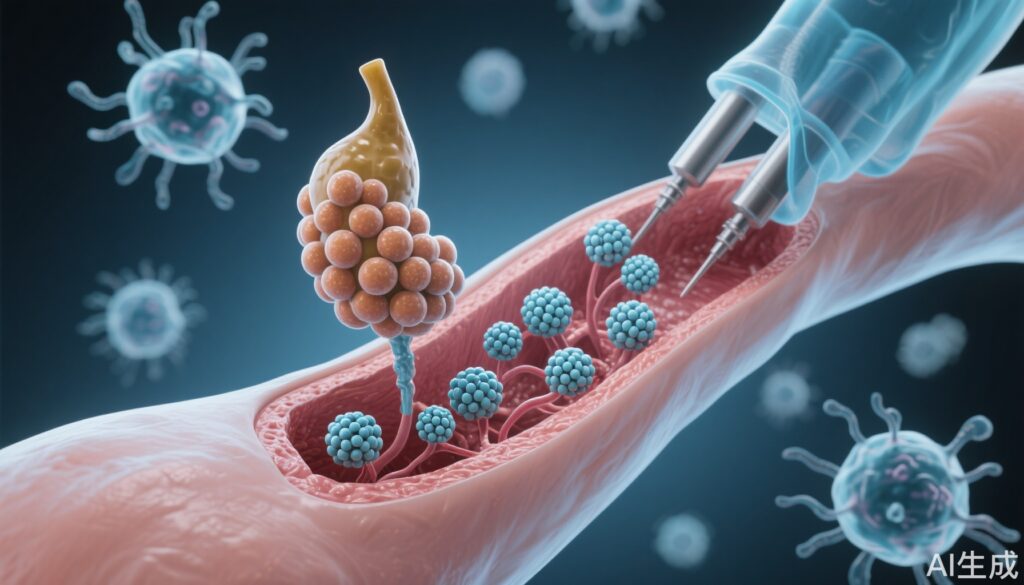
- これは、免疫抑制の必要なく同種異体島細胞移植が行われた最初の人間の症例であり、高度なゲン編集により可能になりました。
- CRISPR–Cas12b とレントウイルス媒介を用いて免疫逃避免島細胞を作製し、1型糖尿病患者において機能的なインスリン分泌が確認されました。
- 移植後12週間で免疫拒絶や重大な副作用は観察されず、Cペプチドと血糖反応性が安定していました。
- このアプローチは、1型糖尿病や他の自己免疫疾患に対する細胞療法の安全性と有効性の障壁を克服する可能性があります。
研究背景と疾患負担
1型糖尿病(T1D)は、膵臓β細胞の自己免疫性破壊によって特徴付けられ、生涯にわたるインスリン依存と深刻な合併症のリスクがあります。島細胞移植は、内因性インスリン生産の回復に治療的有望性を示していますが、慢性免疫抑制の必要性により制限されています。免疫抑制レジメンには感染症、悪性腫瘍、腎毒性、代謝副作用などの重大なリスクがあり、その使用は選択された患者集団に限定されています。したがって、免疫抑制なしで同種異体島細胞の持続的な定着を可能にする戦略の重要な未充足のニーズがあります。
研究デザイン
Carlssonら(N Engl J Med, 2025)によるこの人間初の探索的症例報告では、長期1型糖尿病男性患者への遺伝子変更同種異体島細胞移植について記述しています。主な側面は以下の通りです。
- デザイン:単一被験者、概念実証介入
- 対象者:確立された1型糖尿病かつ内因性インスリン生産が検出不能な成人男性
- 介入:CRISPR–Cas12b とレントウイルスベクターを用いて免疫認識を回避するように遺伝子工学的に改変された同種異体ドナー由来の島細胞を前腕筋肉に移植
- 比較群:なし(単一群報告)
- 評価項目:主要:移植細胞に対する免疫応答;次要:Cペプチド分泌(内因性インスリンのマーカー)、血糖コントロール、副作用
主要な知見
- 免疫逃避と移植片の生存:移植後12週間で、受容者は免疫拒絶の臨床的または実験室的証拠がありませんでした。免疫学的検査では、ゲン編集島細胞に対するホストT細胞や抗体反応が見られませんでした。特に、患者は免疫抑制薬を一切投与されていませんでした。
- 機能的アウトカム:Cペプチドレベル(内因性β細胞活動の直接的なバイオマーカー)は検出可能で安定しており、移植片の生存とインスリン分泌を示唆しています。重要的是、Cペプチドはグルコースチャレンジに対応して適切に増加し、生理的なグルコース応答性のインスリン放出を確認しました。
- 安全性:フォローアップ中に4つの副作用が報告されましたが、いずれも重大なものではなく、移植細胞に関連したものではありませんでした。感染症、低血糖、全身的な合併症は観察されませんでした。
- 技術的アプローチ:島細胞は、主要な免疫認識分子(おそらくHLAクラスIおよびIIを含む)を除去するためにCRISPR–Cas12b編集を受け、免疫耐性を促進する因子のレントウイルス配達が組み合わされました。筋肉部位は、血管性とモニタリングの容易さから選ばれました。
専門家のコメント
この研究は、人間における免疫逃避免ゲン編集島移植の可能性を示し、1型糖尿病の治療における潜在的なパラダイムシフトを示しています。スケーラビリティと持続性がある場合、このようなアプローチは免疫抑制の必要性を解消し、細胞療法へのアクセスを広げ、関連するリスクを軽減することができます。
専門家の意見は慎重に楽観的です。島生物学のリーダーであるO. Korsgren博士は、「これは単一症例ですが、免疫抑制なしでの拒絶の欠如と機能的なインスリン分泌の存在は、この分野で前例のないこと」と述べています。しかし、専門家はいくつかの制限点を指摘しています。
- 単一患者データ:再現性、持続性、遅発的な免疫や発がんリスクの欠如を確認するために、より大規模で長期的な研究が必要です。
- ゲン編集のリスク:CRISPR技術は急速に進歩していますが、オフターゲット効果と予期せぬ免疫原性に対する継続的な監視が必要です。
- 翻訳上の課題:細胞製造のスケーリングアップ、一貫した免疫逃避の確保、免疫エスケープのモニタリングが主要な課題です。
ドナー細胞からの免疫活性化信号の標的除去という生物学的根拠は強く、最近の前臨床研究はこれらの効果の持続性を支持しています。ただし、ヒトの免疫系はより複雑であり、長期フォローアップが不可欠です。
結論
このブレイクスルー症例は、免疫抑制関連毒性の欠如と持続的なβ細胞機能を伴うゲン編集免疫逃避免島移植の可能性を強調しています。これは大きな進歩を代表しています。ただし、長期的な安全性、有効性、一般化可能性を確立するために、より広範な研究が必要です。成功すれば、このアプローチは糖尿病ケアだけでなく、移植医療全体の風景を再構築する可能性があります。
参考文献
1. Carlsson PO, Hu X, Scholz H, Ingvast S, Lundgren T, Scholz T, Eriksson O, Liss P, Yu D, Deuse T, Korsgren O, Schrepfer S. Survival of Transplanted Allogeneic Beta Cells with No Immunosuppression. N Engl J Med. 2025 Aug 4. doi: 10.1056/NEJMoa2503822.
2. Shapiro AM, Pokrywczynska M, Ricordi C. Clinical islet transplantation—state of the art. Nat Rev Endocrinol. 2021 May;17(5):267-287.
3. Deuse T, Hu X, Gravina A, Wang D, Tediashvili G, De C, et al. Hypoimmunogenic cell grafts survive long term in fully immunocompetent allogeneic recipients. Nat Biotechnol. 2019 Aug;37(8):952-963.