ハイライト
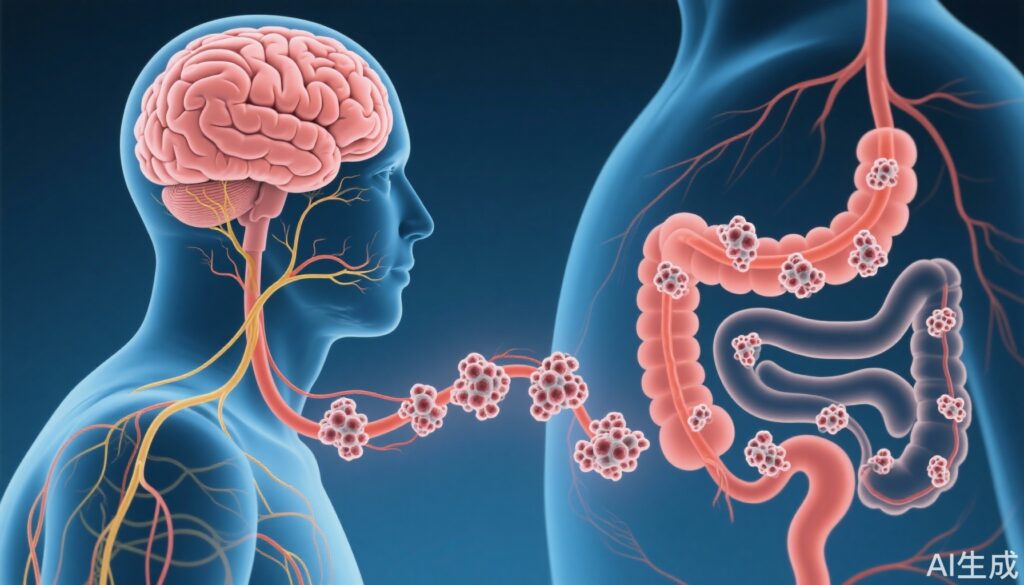
- アルツハイマー病(AD)モデルにおいて、病理的なタウが海馬から迷走神経の運動ニューロンを介して大腸の腸神経系へと広がることが確認されました。
- 迷走神経切断術はタウの伝播を大腸への伝達を著しく減少させ、迷走神経がタウの伝播に重要な役割を果たすことを示しています。
- 革新的な腸チップ・オン・チップモデルは、脳-腸軸を再現し、タウの伝播が大腸上皮の安定性に及ぼす影響を示しました。
- これらの知見は、脳から腸への病理的なタウの伝播を直接証明し、アルツハイマー病の病態における迷走神経の重要性を強調しています。
研究の背景と疾患の負担
アルツハイマー病(AD)は、臨床的には認知機能の低下、病理的には脳内のアミロイドβ(Aβ)斑およびタウ神経原線維変化を特徴とする進行性の神経変性疾患です。高齢化する人口の中で増加傾向にあることから、世界中で深刻な公衆衛生課題となっています。
中枢神経系(CNS)の病態に加えて、新規の証拠はアルツハイマー病が周辺臓器、特に脳腸軸(GBA)を通じて影響を与える可能性を示唆しています。GBAは、CNSと消化管との間で神経、免疫、内分泌の相互作用を介した双方向の通信システムです。以前の研究では、アルツハイマー病患者の腸内細菌叢の変化と腸機能障害が報告されていましたが、アルツハイマー病の病態がどのように直接腸組織に影響を与えるかのメカニズムについては十分に理解されていませんでした。
タウの病態が脳以外にどのように広がるかを理解することは、アルツハイマー病の病態発生の新しい側面を明らかにし、腸の関与を対象とした新たな治療戦略を開く可能性があります。また、全身的な疾患表現を理解する上で重要です。
研究デザイン
Choiらの研究は、多角的な実験アプローチを採用しました。まず、人間のタウ変異を発現するADLPAPTトランスジェニックマウスモデルを使用し、アルツハイマー病のタウ病態を再現しました。目的は、病理的なタウが脳から大腸へと伝播する過程を追跡することでした。
研究デザインの主要な要素には以下の通りです。
– 海馬、迷走神経背側運動核(DMV)、大腸神経叢でのタウ凝集体の免疫組織化学的および生化学的解析。
– ADLPAPTマウスでの手術による迷走神経切断術(vagal nerve cut)を行い、迷走神経がタウの伝播を媒介しているかどうかを確認。
– 人間の誘導多能性幹細胞(iPSC)由来の迷走運動ニューロン、腸神経ニューロン、大腸上皮細胞を組み込んだ革新的な腸チップ・オン・チップモデルの構築により、in vitroで脳-腸軸を模擬。
評価されたエンドポイントは、迷走神経路を介したタウの伝播、大腸組織内でのタウ凝集体の存在と分布、大腸上皮構造の完全性への影響です。
主要な知見
ADLPAPTマウスモデルでは、アルツハイマー病の特徴的な脳構造だけでなく、大腸の神経叢でもタウの病態が検出されました。これは、周辺神経系への関与を示唆しています。
具体的には:
– タウ凝集体は一貫して海馬で観察され、さらに迷走神経背側運動核(DMV)にも広がりました。DMVは、迷走神経の運動出力を担当する脳幹領域です。
– タウの病態は、DMVから大腸の神経叢内の腸神経ニューロンまでさらに広がりました。
– 迷走神経切断術を受けたADLPAPTマウスでは、大腸でのタウの存在が著しく減少し、迷走神経が脳から腸へのタウ伝播を仲介する神経路仮説を支持しています。
腸チップ・オン・チップシステムは、in vitroでこの伝播路を再現しました。
– 迷走運動ニューロンがタウ凝集体を伝播し、下流の腸神経ニューロンにタウの病態を伝えることに成功しました。
– このタウ伝播は、大腸上皮バリアの完全性の低下に関連しており、腸生理学に機能的な影響があることを示唆しています。
これらの知見は、病理的なタウが迷走神経の運動繊維を介して移動し、腸神経ニューロンに影響を与え、大腸上皮の安定性を損なうメカニズムを示しています。
専門家のコメント
これらの知見は、アルツハイマー病研究において、定義された解剖学的経路を介して脳から周辺臓器への直接的なタウ病態の伝播を示す重要なギャップを埋めています。迷走神経の関与は、既知の神経解剖学的接続性に適合し、神経変性疾患における脳腸軸の役割に関する新興データを補完します。
制限点としては、単一のトランスジェニックマウスモデルとin vitroシミュレーションに依存しているため、人間の生理学のすべての複雑さを捉えきれていない可能性があります。また、大腸上皮への影響が確認されていますが、アルツハイマー病患者の胃腸症状への直接的な臨床的関連性はさらなる検証が必要です。
専門家は、in vivoとオルガン・オン・チップ技術の優雅な組み合わせを、CNS以外の複雑な神経免疫相互作用を解明する強力なプラットフォームとして認めています。今後の研究では、迷走神経経路や腸内のタウ凝集体を対象とした介入がアルツハイマー病の進行を抑制できるかどうかを調査する可能性があります。
結論
Choiらの研究は、アルツハイマー病において病理的なタウが迷走神経の運動路を介して脳から大腸へと伝播する堅固な証拠を提供しています。このパラダイムを変える発見は、アルツハイマー病の病態範囲をCNSを超えて延長し、脳腸軸を介した周辺神経系の関与を示唆しています。
これらの洞察は、アルツハイマー病の病態生理学的理解を深め、迷走神経や周辺のタウ沈着を対象とした介入が潜在的な新たな治療戦略であることを示唆しています。さらに、腸チップ・オン・チップモデルの使用は、神経変性疾患における腸の関与に焦点を当てた将来のメカニズムや薬理学的研究のための柔軟なツールを提供します。
継続的および今後の研究では、この伝播が人間における胃腸症状、全身炎症、アルツハイマー病の進行にどのような影響を与えるかを検討し、これらの知見を臨床的に翻訳する必要があります。
参考文献
Choi H, Hong SB, Liu HW, Song H, Jeong JH, Ahn K, Kim S, Song J, Han JW, Lee D, Ahn J, Kim MS, Chung S, Mook-Jung I. Pathological tau propagation from the brain to the colon via the vagal efferent pathway in Alzheimer’s disease. Gut. 2025 Sep 1:gutjnl-2024-334571. doi: 10.1136/gutjnl-2024-334571. Epub ahead of print. PMID: 40890024.
関連文献:
– Holmqvist et al., 2014. Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol.
– Pan-Montojo et al., 2010. Environmental toxins trigger PD-like progression via the gut. Neurobiol Dis.
– Kim et al., 2020. The gut microbiota and Alzheimer’s disease. J Alzheimers Dis.
– Wang and Wang, 2022. Role of the gut–brain axis in neurodegenerative diseases. Front Neurosci.