はじめに
神経変性疾患(NDs)にはアルツハイマー病(AD)、パーキンソン病(PD)、脳卒中、筋萎縮性側索硬化症(ALS)、ハンチントン病(HD)、多発性硬化症(MS)、てんかんなどがあり、世界中で重大な罹患率と死亡率を引き起こしています。これらの疾患は進行性の神経細胞機能不全を特徴とし、タンパク質の異常折りたたみや凝集、ミトコンドリア機能不全、酸化ストレス、慢性神経炎症などの複雑な病態メカニズムに関与します。多くの研究が行われていますが、現行の治療法は主に症状緩和に留まり、疾患進行を止めることが困難です。したがって、革新的な治療戦略が必要とされています。
エクソソームは、さまざまな細胞から産生される30〜100 nmの小さな細胞外小胞であり、中枢神経系(CNS)における細胞間通信の有力な媒介者として注目を集めています。血脳関門(BBB)を通過する能力、低い免疫原性、天然の物質運搬能力などの内在性特性により、エクソソームは治療分子の配達や早期診断のバイオマーカーとして有望な候補となっています。
本稿では、神経変性疾患におけるエクソソームの治療的潜在性についてレビューし、遺伝子、化学、ナノ材料の修飾技術を通じて標的化と効果を高める新規戦略を詳細に説明します。最近の前臨床研究の成果を強調し、現在の課題を指摘し、臨床応用への将来展望についても議論します。
神経変性疾患におけるエクソソーム
エクソソームは、細胞内でのエンドソーム処理によって生成され、細胞外空間に放出されます。エクソソームはプロテイン、リピッド、mRNA、マイクロRNA(miRNA)などの生体活性分子を運び、受容細胞にこれらの物質を転送することで、免疫反応、シナプス機能、細胞恒常性を調節します。
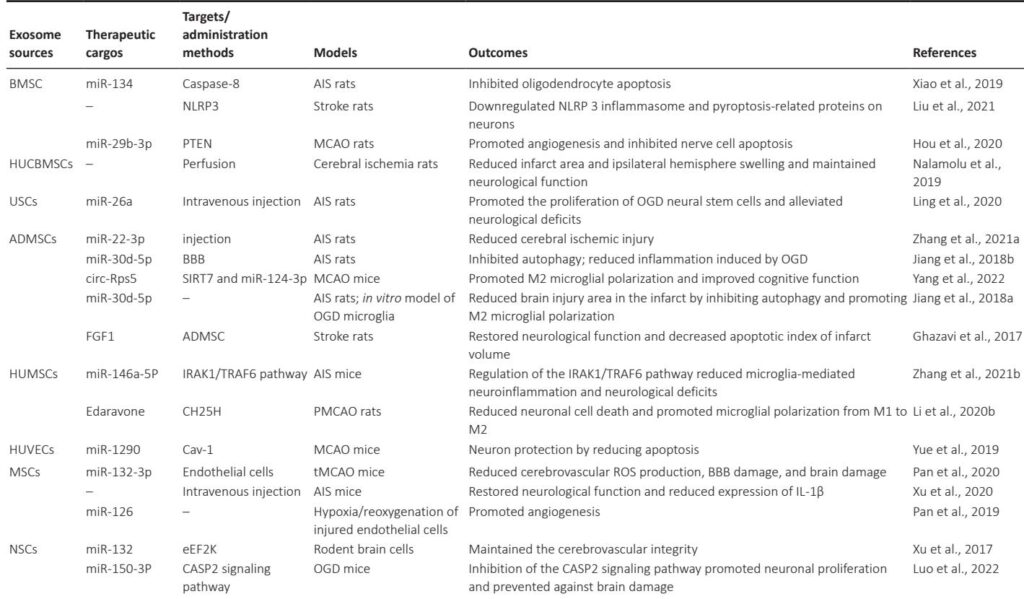
ADでは、エクソソームはアミロイドβ(Aβ)とタウ凝集体の病理的な広がりと除去に寄与します。治療的miRNA(例:PTENを標的とするmiR-223)を載せた間葉系幹細胞由来のエクソソーム(MSC-エクソソーム)は、炎症を抑制し、神経細胞のアポトーシスを減らし、動物モデルにおいて認知機能の改善を示す神経保護効果を示しました。ラビーズウイルス糖蛋白(RVG)ペプチドで修飾されたエクソソームは、BBB透過性とミクログリア取り込みを高め、治療物質の配達をさらに強化します。
PDでは、エクソソームは抗酸化酵素、神経栄養因子、α-シヌクレイン凝集体を標的とするsiRNAの配達手段として利用されます。多くの研究が、MSC-エクソソームの投与がドーパミンニューロンの損失を軽減し、神経炎症を抑制し、運動機能を回復することを示しています。miR-133bを運ぶエクソソームは、樹状突起の伸展を促進し、シナプス可塑性を高めます。
脳卒中の管理では、血管新生因子や神経新生因子(例:ヒト尿または骨髄由来の間葉系幹細胞からのmiR-210とmiR-126)をエクソソームで配達することで恩恵を受けます。エクソソームは虚血領域の大きさを減らし、神経細胞のアポトーシスを抑制し、ミクログリア活性を調整し、機能回復を早めます。特に、エクソソームの天然性は、合成ナノ粒子と比較して標的化と免疫クリアランスの回避に有利です。
これら以外にも、エクソソームはALS、HD、MS、てんかんにおいて、神経炎症、酸化ストレス、病原性タンパク質凝集体の調節により、幅広いNDsに適用可能であることを示しています。
エクソソームの標的化と治療効果の向上のための修飾
天然のエクソソームは著しい治療能力を示していますが、固有の標的細胞特異性の欠如により、非標的組織への取り込みや効果の低下が原因で臨床応用が制限されます。したがって、新技術は標的化、負荷、配達の最適化に焦点を当てています。
遺伝子工学
遺伝子改変は、エクソソームを産生する細胞に標的リガンドやペプチドを付加する融合タンパク質をコードするプラズミドを導入することを含みます(例:Lamp2b)。このアプローチにより、RVGなどのリガンドの表面表示が可能になり、CNS標的化が向上します。また、心臓疾患のための心臓特異的ペプチドも標的化できます。
例としては、siRNAの負荷を促進するCD9-HuR融合、アミロイド前駆タンパク質を標的とするFe65ペプチド融合があり、ADモデルにおける標的自食作用の誘導を容易にします。遺伝子工学は精密なリガンド組み込みを可能にする一方で、複雑な製造と高いコストが求められます。
化学修飾
化学アプローチには、共役と非共役の表面機能化が含まれます。共役修飾は主に生物正規直結クリック化学を利用し、アジド-アルキン環付加反応を利用して標的モイエティやナノ粒子を接合します。例えば、スーパーパラマグネット性酸化鉄ナノ粒子(SPIONs)とネウロフィリン-1標的ペプチドを接合したエクソソームは、膠腫への標的化とイメージング能力を向上させます。
非共役戦略は、静電相互作用、リガンド-レセプター結合、リポソームとの疎水性融合、アプタマーの組み込み、CD63エクソソームテトラスパニンへのCP05ペプチドのアンカー化を用います。これらはエクソソームの整合性に最小限の影響を与える可逆的な表面修飾を可能にします。例えば、DOPE-NHSリンカーを介して結合したRVGペプチドは、MSC-エクソソームの脳配達を増加させます。
ナノ材料の統合
ナノ材料との統合はエクソソームの機能を拡張します。金属-有機フレームワークや金ナノ粒子がエクソソーム上または内部に組み込まれることで、薬物の負荷、追跡、制御放出が可能になります。ナノ材料強化エクソソームは、薬物の安定性、標的蓄積、リアルタイムイメージングを改善し、治療診断アプリケーションをサポートします。
研究者は、PDモデルにおいて、水溶性のない薬物の配達や、α-シヌクレインのような病原性タンパク質の除去に成功しており、薬物溶解性の問題を克服し、治療効果を向上させる有用性を示しています。
課題と制約
有望な前臨床結果にもかかわらず、エクソソームベースの療法の臨床応用にはいくつかの障壁があります。エクソソームの源のばらつき、貨物組成の異質性、大規模精製の課題により標準化が複雑になります。エクソソームは短い全身半減期と急速なクリアランスを示し、持続的な治療効果のために最適化が必要です。
非標的細胞との予期しない相互作用や病原性タンパク質の転送による潜在的な副作用の厳格な安全性評価が必要です。特に、間葉系幹細胞由来のエクソソームでは、素材や規制監督に関する倫理的な問題が生じます。
技術的な課題には、効率的な貨物負荷、保存時の安定性、高収量かつ再現可能な生産方法の開発が含まれます。エクソソームの体内動態と運命を正確に追跡するためのキャラクタリゼーションやイメージング技術の進歩が必要です。
結論と今後の展望
エクソソームは、血脳関門を通過する能力と細胞間通信を媒介する内在性能力により、神経変性疾患の診断と治療の新しい多様なプラットフォームを提供します。間葉系幹細胞由来のエクソソームは、複数のNDモデルにおいて強力な再生、免疫調節、神経保護効果を示しています。さらに、遺伝子工学、化学結合、ナノ材料の組み込みによる表面修飾により、標的特異性と治療効果が大幅に向上します。
臨床応用の実現には、生産のスケーラビリティ、精製の標準化、安全性プロファイル、制御された貨物負荷に焦点を当てる必要があります。ナノテクノロジー、分子生物学、臨床神経科学を統合した学際的な努力が不可欠です。
最終的に、エンジニアリングされたエクソソームベースのプラットフォームは、精密医療のツールとして有望であり、破壊的な神経変性疾患の進行を変える効果的な治療法への希望を提供します。