亮点
伊匹木单抗和纳武利尤单抗联合使用的双免疫检查点阻断未能改善MGMT未甲基化新诊断胶质母细胞瘤患者的无进展生存期,与标准替莫唑胺化疗相比。II期试验未能达到主要终点,导致研究提前终止,未进入III期。安全性特征与已知效应一致,未出现新的不良信号。
分子相关研究和持续的生存随访可能为这一难以治疗的亚组提供未来的治疗策略。
研究背景和疾病负担
胶质母细胞瘤(GBM)仍然是成人中最常见且最具侵袭性的原发性脑恶性肿瘤,尽管采用多模式治疗,但预后仍较差。目前的标准治疗包括最大限度的安全手术切除,随后进行放疗联合替莫唑胺(TMZ)化疗。然而,携带MGMT启动子未甲基化(’uMGMT’)胶质母细胞瘤的患者从TMZ中获益较少,因为存在内在耐药性。这一亚组面临显著较短的无进展生存期(PFS)和总生存期(OS),突显了对新型疗法的迫切需求。
针对CTLA-4(伊匹木单抗)和PD-1(纳武利尤单抗)的免疫检查点抑制剂已在多种恶性肿瘤中改变了治疗范式,但在胶质母细胞瘤中尚未表现出明确的益处。早期的I期研究,包括NRG肿瘤学BN002试验,建立了伊匹木单抗和纳武利尤单抗联合使用的安全性和潜在疗效信号,这促使设计了针对uMGMT GBM人群的NRG肿瘤学BN007随机II/III期试验,测试双免疫检查点阻断是否能改善标准TMZ的预后。
研究设计
NRG肿瘤学BN007是一项随机、对照、开放标签的II/III期临床试验,纳入了新诊断、组织学确诊的MGMT未甲基化胶质母细胞瘤成人患者。符合条件的患者Karnofsky表现状态(KPS)≥70,并已接受最大限度的安全切除。
参与者以1:1的比例随机分配接受放疗联合免疫治疗(伊匹木单抗加纳武利尤单抗)或标准替莫唑胺化疗。分层因素包括递归分区分析(RPA)类别(III、IV、V)和计划使用肿瘤治疗电场。
关键方案特征包括在免疫治疗开始时禁止使用皮质类固醇以最小化免疫抑制,以及集中确认诊断、生物标志物状态(MGMT甲基化)和PFS事件。II期的主要终点是无进展生存期(PFS),研究有95%的把握度检测出有利于免疫治疗的风险比(HR)≤0.58,在单侧显著性水平为0.15的情况下。如果II期PFS成功,则将继续进行III期总生存期(OS)分析。
 Afte
Afte
主要发现
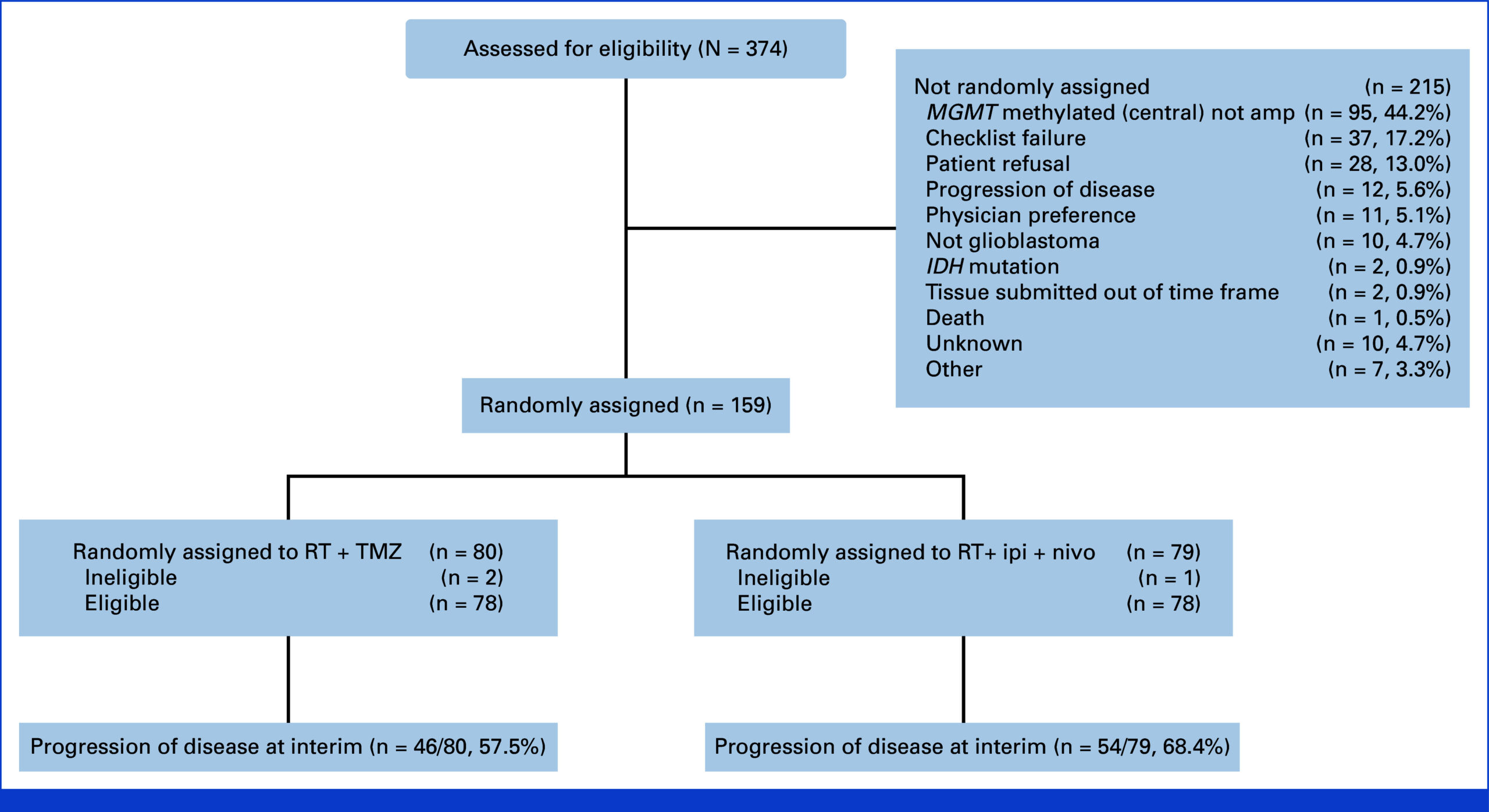
从入组完成到预先计划的中期分析期间,共有159名患者被随机分配:79名至免疫治疗组,80名至TMZ组。基线人口统计学和临床特征平衡良好,中位年龄60岁,66%为男性,大多数(61%)KPS为90-100,65%实现了全切除。RPA类别的分布主要为IV类(73%)。
在100例中央裁定的进展事件后,中期分析显示,与TMZ相比,免疫治疗未改善PFS。伊匹木单抗加纳武利尤单抗组的中位PFS为7.7个月,而TMZ组为8.5个月(风险比,1.47;70%置信区间,1.19至1.83)。单侧P值为0.96,表明实验组没有统计学意义的优势。
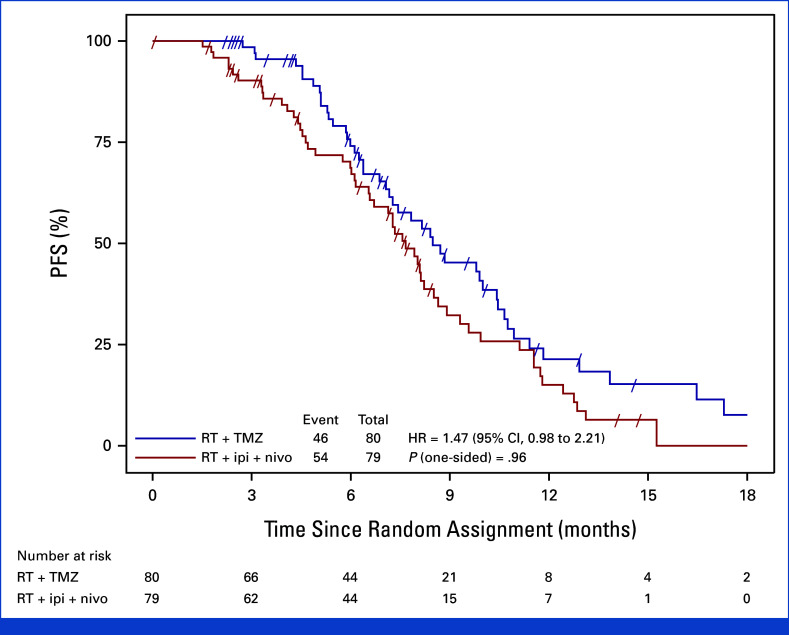
总体生存数据尚不成熟,超过50%的参与者在分析时仍然存活;两组的中位OS约为13个月(HR,0.95;95% CI,0.61至1.49;P = 0.36),显示双免疫检查点阻断没有生存优势。
关于安全性,除了已知的伊匹木单抗和纳武利尤单抗不良事件谱外,未出现新的毒性信号。免疫相关不良事件可管理,并且与之前的报告没有显著差异。值得注意的是,为了优化免疫反应,在免疫治疗开始时禁止使用皮质类固醇。
专家评论
这项试验增加了越来越多的证据,即尽管检查点抑制剂在多种实体瘤中表现出显著影响,但在新诊断的胶质母细胞瘤中,尤其是在MGMT未甲基化的亚组中,其疗效可能有限。微环境因素、血脑屏障挑战和有限的T细胞浸润可能是这些令人失望的结果的原因。
伊匹木单抗和纳武利尤单抗未能改善PFS或OS的结果与其他胶质母细胞瘤免疫治疗研究的类似结果相符。该试验的稳健设计,包括集中确认分子状态、良好的分层人群和仔细的皮质类固醇管理,增强了这些结论的信心。
局限性包括相对早期的中期分析和不成熟的OS数据,尽管PFS风险比强烈反对免疫治疗的益处。未来的研究应探索增强免疫浸润或与检查点抑制剂结合靶向其他肿瘤脆弱性的组合方法。
结论
NRG肿瘤学BN007随机II期试验显示,在接受放疗的新诊断MGMT未甲基化胶质母细胞瘤患者中,伊匹木单抗与纳武利尤单抗联合使用并未改善无进展生存期,优于替莫唑胺。因此,该试验在进入III期OS分析之前永久关闭。
这些发现强调了在胶质母细胞瘤中推进免疫治疗的持续挑战,以及这一患者亚组中替代策略的迫切需求。本试验的持续分子和相关研究可能提供见解,指导未来的个性化免疫治疗策略。
参考文献
1.Lassman AB, Polley MC, Iwamoto FM, Sloan AE, Wang TJC, Aldape KD, Wefel JS, Gondi V, Gutierrez AN, Manasawala MH, Gilbert MR, Sulman EP, Wolchok JD, Green RM, Neil EC, Lukas RV, Goldlust SA, Snuderl M, Galbraith K, Dignam JJ, Won M, Mehta MP. Dual Immune Check Point Blockade in MGMT-Unmethylated Newly Diagnosed Glioblastoma: NRG Oncology BN007, a Randomized Phase II/III Clinical Trial. J Clin Oncol. 2025 Sep 20;43(27):3032-3040. doi: 10.1200/JCO-25-00618 IF: 41.9 Q1 . Epub 2025 Aug 8. PMID: 40779733 IF: 41.9 Q1 ; PMCID: PMC12440284 IF: 41.9 Q1 .
2. Stupp R, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med. 2005;352(10):987-96.
3. Reardon DA, et al. Immunotherapy advances for glioblastoma. Neuro Oncol. 2020;22(4):555-565.
4. Clarke JL, et al. The role of immune checkpoint blockade in glioblastoma: mechanisms and clinical outcomes. Nat Rev Clin Oncol. 2021;18(4):234-246.