亮点
- 人工智能数字病理学(DP)显著提高了纤维化分期的病理医生间一致性,特别是在MASH早期纤维化(F0-F2)阶段。
- 结合二次谐波生成/双光子激发荧光(SHG/TPEF)成像和人工智能定量纤维化(qFibrosis)技术,增强了纤维化严重程度的可视化和客观评估。
- 人工智能辅助增加了临床试验纳入/排除标准的一致性以及纤维化反应的评估,可能减少仲裁需求并提高试验效能。
研究背景与疾病负担
代谢功能障碍相关脂肪性肝炎(MASH),以前称为非酒精性脂肪性肝炎(NASH),是全球慢性肝病日益增长的原因。MASH以肝脂肪变性、炎症和不同程度的纤维化为特征,与肥胖、胰岛素抵抗和代谢综合征并发症密切相关。纤维化分期是MASH不良临床结果的最重要组织学预测因子,影响预后和治疗决策。
通过肝活检准确评估肝纤维化仍然是临床金标准;然而,纤维化分期在病理医生之间的显著差异使得患者选择临床试验和评估治疗效果变得复杂。这种观察者间差异,尤其是在对试验纳入至关重要的早期纤维化阶段,可能导致患者入选不一致和试验统计功效降低。
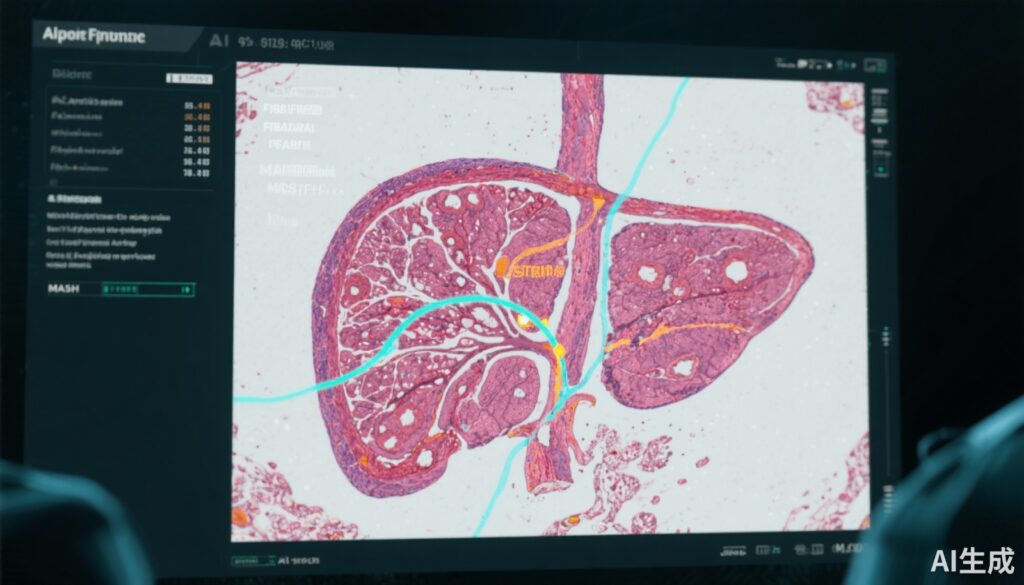
新兴的数字病理学平台结合了人工智能(AI)方法,旨在通过提供定量和更可重复的纤维化评估工具来增强病理医生的评估。本研究评估了一个利用SHG/TPEF成像和AI驱动的定量纤维化测量的人工智能数字病理学系统,以提高MASH肝活检中纤维化分期的可靠性。
研究设计
本研究分析了来自两个注册编号分别为NCT03517540和NCT03912532的二期/三期临床试验的120张数字化肝组织学切片。四位专家肝病理医生独立地对这些切片进行纤维化分期评分,既包括有人工智能辅助的情况,也包括没有人工智能辅助的情况,采用随机两周期交叉设计以控制潜在的学习或疲劳效应。
人工智能数字病理学平台利用无标记的SHG/TPEF成像,这是一种能够高对比度可视化胶原纤维的方法,结合AI衍生的定量纤维化指标(qFibrosis)。这些定量值提供了连续的纤维化评估,同时提供分类分期输出,以协助病理医生评分。
主要终点包括通过Cohen’s kappa值评估的病理医生间和病理医生内一致性变化。次要分析评估了与试验纳入/排除标准(F2-F3期纳入;F0/F1/F4期排除)相关的符合性以及对治疗反应的纤维化评估。
关键发现
人工智能辅助显著提高了纤维化分期的病理医生间一致性,特别是在传统上变异最大的早期纤维化阶段(F0-F2)。引入人工智能支持后,评分者间kappa值从约0.4提高到0.7,表明一致性显著增强。引入人工智能辅助后,纤维化分期中位数周围的方差也显著减少。
值得注意的是,人工智能辅助并未改变病理医生内的稳定性,这表明个体病理医生的可靠性不受人工智能辅助的影响。
关于临床试验病例分类,纳入病例(F2-F3)的一致性从没有人工智能时的45%提高到有人工智能时的71%,而排除病例的一致性从38%提高到55%。同样,评估治疗反应的纤维化一致性从49%提高到61%。
病理医生对人工智能平台各组件的实用性评估如下:SHG/TPEF图像在83%的病例中被认为有用,qFibrosis连续值在55%的病例中有用,qFibrosis分期在38%的病例中有用,强调了增强可视化和定量指标的价值。
将这些改进应用于临床试验的情境下,预计仲裁过程的需求将减少约25%,统计功效可能增加45%,从而实现更小的样本量或更高效的研究设计。
专家评论
人工智能在数字病理学中的应用解决了MASH临床研究中的一个关键未满足需求,减少了纤维化分期的主观变异性。SHG/TPEF成像和人工智能定量评估的结合提高了纤维化评估的客观性和可重复性,特别是在检测具有挑战性的早期和中期纤维化阶段。
尽管病理医生内的可靠性保持不变,但增强的病理医生间一致性直接影响了临床试验的稳健性,通过统一患者资格确定和治疗反应评估。这种技术增强可以通过更精确的组织学终点加速药物开发时间表并降低相关成本。
尽管结果令人鼓舞,但局限性包括研究仅限于专家肝病理医生,这可能无法推广到普通病理医生或社区环境。在更大队列和现实世界环境中,包括不同病理医生专业水平的前瞻性验证将是广泛采用的关键。此外,与其他无创纤维化标志物和临床参数的整合可以优化诊断流程。
结论
人工智能辅助数字病理学,特别是利用SHG/TPEF成像和AI衍生的定量纤维化指标,显著提高了MASH纤维化分期的病理医生间一致性。这一改进在对临床试验资格和疾病监测至关重要的早期纤维化阶段尤为明显。增强的一致性可能减少仲裁负担并提高临床试验效能,从而在临床研究效率和治疗评估方面提供有意义的进步。
未来的工作应集中在多中心前瞻性研究中验证人工智能工具,扩大超出专家中心的访问范围,并将这些平台整合到常规病理实践,以改善患者护理并加速MASH的治疗发现。
参考文献
1. Abdurrachim D, Lek S, Ong CZL, et al. Utility of AI digital pathology as an aid for pathologists scoring fibrosis in MASH. J Hepatol. 2025 May;82(5):898-908. doi:10.1016/j.jhep.2024.11.032 .2. Dulai PS, Singh S, Patel J, et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology. 2017;65(5):1557-1565.3. Kalia HS, Gaglio PJ, Hooker CA, et al. Histological agreement of NASH fibrosis among pathologists in clinical practice. Mod Pathol. 2020;33(7):1418-1426.
4. Liu Y, Guo J, Chen Y, et al. Use of second harmonic generation microscopy for collagen assessment in liver fibrosis. Biosensors (Basel). 2021;11(5):162.