ハイライト
- BRADiNP無作為化クロスオーバー試験では、糖尿病性神経障害痛(DNP)に対するfulmetibantは、プラセボと比較して有意な鎮痛効果がなかったことが示されました。
- 前臨床的な有望性にもかかわらず、1日1回450 mgのfulmetibant投与レジメンは、痛みのある遠位対称性感覚運動神経障害を持つ患者の24時間平均疼痛強度を有意に低下させることはできませんでした。
- 副作用は主に軽度または中等度で、fulmetibant群では41.8%の患者、プラセボ群では32.9%の患者に見られ、管理可能な安全性プロファイルを示しました。
- 本研究は、DNPの管理における有効な治療法の未充足需要と、分子標的を臨床治療に移行する際の課題を強調しています。
研究背景と疾患負荷
糖尿病性神経障害痛(DNP)は、1型および2型糖尿病を含む、長期の糖尿病患者の最大50%に影響を及ぼす一般的で深刻な合併症です。DNPは、痛みのある遠位対称性感覚運動神経障害の特徴があり、主に下肢で持続的な焼けるような、刺すような、電撃のような痛みを引き起こします。この慢性痛は生活の質を大幅に損なうだけでなく、睡眠障害を引き起こし、効果的な管理が困難です。現在の薬物療法(抗てんかん薬、抗うつ薬、オピオイドなど)はしばしば不十分な効果しか提供せず、著しい副作用を伴うことが多い。
ブラジキニンは、炎症性ペプチドであり、ブラジキニン-1受容体(B1R)の作用を通じて神経障害痛の経路に関与しています。B1Rは慢性炎症や神経損傷時に上昇します。前臨床モデルでは、B1R拮抗作用が神経障害痛を軽減することが示され、選択的なB1R拮抗薬であるfulmetibantは、DNPの新しい鎮痛薬候補として有望であると考えられています。
研究デザイン
BRADiNP試験(ClinicalTrials.gov NCT05219812)は、多施設共同、無作為化、二重盲検、プラセボ対照、二群完全クロスオーバー第2a相試験でした。本研究では、1型または2型糖尿病を持ち、6ヶ月以上続く痛みのある遠位対称性感覚運動神経障害と測定可能な神経障害痛がある成人が対象となりました。事前のDNP治療を除去するための盲検洗浄期間の後、参加者は1:1の比率で、1日1回450 mgのfulmetibantまたはプラセボを4週間投与されるか、その後4週間別の治療に切り替えるように無作為に割り付けられました。
主要効果評価項目は、各治療期間の第4週目に測定された、基線からの週平均24時間平均疼痛強度スコアの変化でした。二次評価項目には、報告された副作用と実験室パラメータに基づく安全性と忍容性の評価が含まれました。
主要な知見
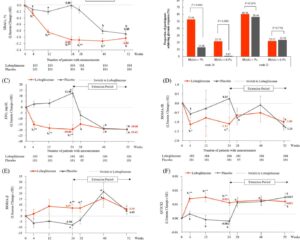
計79人がfulmetibantの治療を開始し、79人がプラセボの治療を開始し、75人が両方の治療期間を完了しました。主要評価項目(第4週目)において、fulmetibantとプラセボの疼痛強度の平均治療差は0.07で、95%信頼区間は-0.170から0.314でした。これは、fulmetibantがプラセボと比較して統計的にも臨床的にも有意な鎮痛効果を示さなかったことを示しています。
効果の欠如は、サブグループ間と二次測定値間で一貫していました。安全性に関しては、fulmetibant群では41.8%の参加者が副作用を報告し、プラセボ群では32.9%でした。ほとんどの副作用は軽度から中等度で、疲労、めまい、胃腸症状が含まれ、fulmetibantに起因する重篤な副作用はありませんでした。
これらの知見は、神経障害痛に対するB1R遮断の理論的な根拠と前臨床的証拠にもかかわらず、試験用量とレジメンのfulmetibantは、DNP患者に対して有意な治療効果を提供しなかったことを示唆しています。
専門家のコメント
BRADiNP試験は、複雑な神経障害痛状態における分子標的治療を臨床に移行する際の課題に関する重要な洞察を提供しています。神経障害痛専門家によれば、糖尿病性神経障害は代謝、血管、神経免疫成分を含む多因子性病態であり、B1R拮抗作用だけでは十分に対応できない可能性があります。
否定的な結果の潜在的な理由には、fulmetibantの中枢神経系への浸透が不十分であること、補償的なプロノシセプティブ経路、患者の痛みメカニズムの異質性などが考えられます。クロスオーバー設計は、個人間の変動を減らすことにより内部妥当性を強化しますが、4週間の治療期間では最大の治療効果を観察するのに時間が短すぎた可能性があります。
今後の研究では、組み合わせ療法、キニン-カリクリン系内の代替標的、バイオマーカープロファイルに基づく患者選択の層別化などを探索する可能性があります。さらに、厳密なメカニズム研究は、B1R阻害が人間のDNPにおいて前臨床的鎮痛効果を再現できなかった理由を明確にするのに役立つかもしれません。
結論
BRADiNP第2a相試験は、ブラジキニン-1受容体拮抗薬であるfulmetibantが、プラセボと比較して痛みのある糖尿病性神経障害患者の神経障害痛強度を有意に軽減しなかったことを示しました。全体的には耐容性が高かったものの、鎮痛効果の欠如はDNPの病態の複雑さと単一標的アプローチの限界を強調しています。
これらの結果は、DNPに対する有効で安全な治療法を特定するために継続的な革新とより深いメカニズム理解の必要性を強調しています。医師は、現在のエビデンスに基づく神経障害痛管理戦略に従いつつ、堅固な臨床評価を受けている新規薬剤に注意を払うべきです。
参考文献
1. Stemper B, Löwen S, Fritsch A, Hoffmann A, Sarkar A. The bradykinin-1 receptor antagonist fulmetibant in patients with diabetic neuropathic pain: the randomized, crossover, placebo-controlled, double-blind, phase 2a BRADiNP study. Pain. 2025 Oct 1;166(10):2421-2429. doi: 10.1097/j.pain.0000000000003642. Epub 2025 May 6. PMID: 40334047.
2. Ziegler D, Fonseca V. From guideline to patient: a review of recent recommendations for pharmacotherapy of painful diabetic neuropathy. J Diabetes Complications. 2015;29(1):146-156.
3. Fields HL. Mechanisms of neuropathic pain: therapeutic implications. Rev Neurol Dis. 2006;3(4):186-193.
4. Kemp TI, Kingsbury L, McNair K, Graham J, Helyes Z, Szabo A. Bradykinin and neuropathic pain: a novel pharmacological target? Eur J Pain. 2017;21(9):1431-1442.