ハイライト
- ベソテグラストは、統合体 $beta_1alpha_6$ と $beta_1alpha_2$ の経口二重阻害剤で、IPF 患者において 12 週間の投与で耐容性が高かった。
- プラセボと比較して、ベソテグラスト投与は強制呼気量(FVC)の低下を抑制し、抗線維化効果を示唆した。
- 定量的肺線維化(QLF)画像と循環バイオマーカー ITGB6 および PRO-C3 は、ベソテグラストにより用量依存的に改善した。
- 薬物の安全性プロファイルは良好で、長期試験での持続的な効果の確立を支持している。
背景
特発性肺線維症(IPF)は、進行性の致死的な肺疾患であり、過剰な線維化によって呼吸機能が障害され、咳や呼吸困難が悪化します。治療せずに生存する中央値は 3 〜 4 年です。現在承認されている治療法であるピルフェニドンとニンテダニブは、病態進行を遅らせるものの、進行を止めるわけではなく、胃腸系の副作用などの耐容性問題がしばしばあります。したがって、より安全で効果的な治療法に対する緊急の未充足の需要があります。
変形成長因子-β(TGF-β2)の活性化は、線維化の主要な駆動力であり、IPF の肺で上昇する統合体 $beta_1alpha_6$ と $beta_1alpha_2$ を介して起こります。これらの統合体を標的として局所的な TGF-β2 の活性化を阻害することは、新しい抗線維化戦略を表しています。ベソテグラスト(PLN-74809)は、これらの統合体を選択的に阻害する経口1日1回投与の小分子であり、TGF-β2 によって引き起こされる線維化の連鎖を防ぎます。
研究デザイン
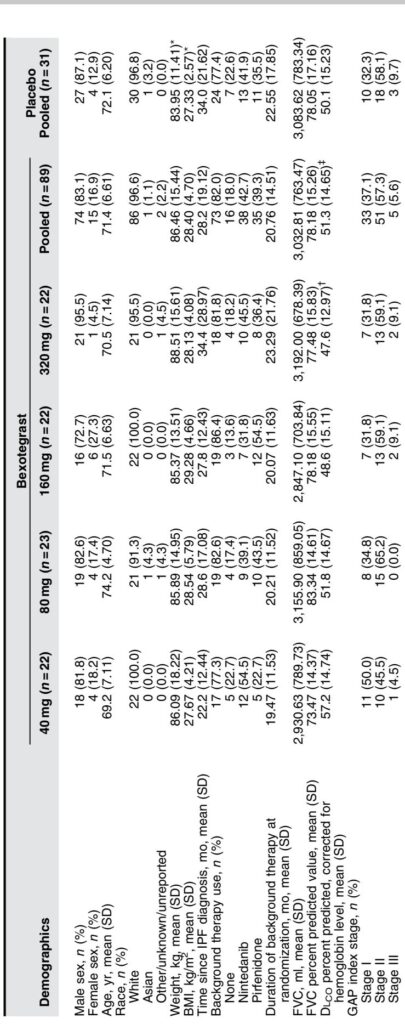
INTEGRIS-IPF 試験(NCT04396756)は、国際的に 39 サイトで実施された第2a相の無作為化、二重盲検、プラセボ対照、用量範囲試験でした。70歳代のIPFが確認された119人の参加者が、40 mg、80 mg、160 mg、320 mg のベソテグラストまたはプラセボを1日1回12週間以上投与されるように 3:1 で無作為に割り付けられました。登録前の3ヶ月以上安定していた背景のIPF治療薬(ピルフェニドンまたはニンテダニブ)の使用が許可され、約80%の参加者が背景治療を受けていました。
主要評価項目は安全性で、特に治療関連の有害事象(TEAE)の発生率に焦点を当てました。探索的有効性評価項目には、基準値から12週間後の強制呼気量(FVC)、高解像度CT(HRCT)による定量的肺線維化の程度、統合体 β-6(ITGB6)およびIII型コラーゲン合成新エピトープ(PRO-C3)などの線維化関連循環バイオマーカーの変化が含まれました。
主要な知見
安全性と耐容性:ベソテグラストは全用量で耐容性が高く、用量依存的な TEAE の増加はなかった。TEAE の全体的な発生率は、ベソテグラスト群(69.7%)とプラセボ群(67.7%)で同等でした。最も多い有害事象は下痢で、主にニンテダニブも受けている参加者で発生しました。これは既知のその薬の効果と一致しています。治療関連の重篤な有害事象や死亡例は報告されていません。血液検査、生命徴候、心電図の評価では安全性シグナルは見られませんでした。
薬物動態:ベソテグラストの曝露は用量にほぼ比例して増加し、予測可能な薬物動態をサポートしました。
有効性:修正された意図治療群(背景治療を受けている割合が80%以上)では、80 mg および 320 mg の用量でベソテグラストが 12 週間で FVC の低下を有意に抑制しました。プラセボ群は平均で FVC が 110.5 ml 低下しましたが、ベソテグラスト群はより少ない低下または小幅な改善を示しました(例えば、320 mg で +29.4 ml)。この肺機能の損失の減少は、背景治療の使用に関係なく観察されました。
FVC 予測値の 10% または絶対値の 10% 以上の相対的または絶対的低下を経験した参加者の割合も用量依存的に減少しました。HRCT に基づく定量的肺線維化の程度は、160 mg および 320 mg の用量でプラセボに対して安定または限定的な進行を示しました。バイオマーカー解析では、血漿 ITGB6 および血清 PRO-C3 レベルの用量依存的な減少が観察され、これらは線維化過程にかかわるため、病態進行を予測します。
延長コホートでは、320 mg で 12 週間で FVC 改善が見られた患者の大多数(88.9%)が 24 週間で改善を維持していました。これは、プラセボ受領者とは異なりました。
専門家のコメント
INTEGRIS-IPF 試験は、ベソテグラストが統合体を介した TGF-β2 の活性化を安全に阻害し、IPF の線維化進行を抑制できるという有望な初期臨床証拠を提供しています。以前の統合体阻害抗体が急性悪化リスクの増加について懸念を引き起こしたのとは異なり、ベソテグラストはそのような安全性シグナルと関連していません。これは、薬剤のモダリティと薬物動態の違いを反映している可能性があります。
本研究における安定した背景抗線維化治療を受けている参加者の包含は、実世界の臨床実践を反映しており、ベソテグラストが追加的な毒性なしに利益をもたらす可能性を示唆しています。ただし、試験の相対的に短い期間(12 週間)と中等規模のサンプルサイズは、長期的な有効性や生存への影響に関する明確な結論を制限しています。短期間の肺機能テストの固有の測定変動性も FVC の変化を複雑にしています。
バイオマーカーと画像データは、ベソテグラストの抗線維化作用の生物学的妥当性を補強しています。ITGB6 の減少は標的統合体の阻害と一致し、PRO-C3 の変化はコラーゲンのターンオーバーの調整を反映しています。
将来の大規模で長期的な試験、例えば進行中の 52 週間 BEACON-IPF 試験は、持続的な利益を確認し、死亡率、生活の質、悪化率などの臨床終点を特徴付けるために不可欠です。参加者の多様性を高めることで、一般化可能性を向上させるべきです。
結論
ベソテグラストは、特発性肺線維症患者の肺機能低下と線維化進行を抑制するうえで、良好な安全性プロファイルと有望な効果を示しています。TGF-β2 の活性化を阻害する主要な統合体を標的とするベソテグラストは、既存の抗線維化治療を補完する新しいメカニズムを提供します。進行中のおよび将来の第3相試験は、その臨床実践における役割と、この深刻な病気の結果を改善する可能性を決定するために重要です。
参考文献
Lancaster L, Cottin V, Ramaswamy M, Wuyts WA, Jenkins RG, Scholand MB, Kreuter M, Valenzuela C, Ryerson CJ, Goldin J, Kim GHJ, Jurek M, Decaris M, Clark A, Turner S, Barnes CN, Achneck HE, Cosgrove GP, Lefebvre c9A, Flaherty KR; PLN-74809-IPF-202 Trial Investigators. Bexotegrast in Patients with Idiopathic Pulmonary Fibrosis: The INTEGRIS-IPF Clinical Trial. Am J Respir Crit Care Med. 2024 Aug 15;210(4):424-434. doi: 10.1164/rccm.202403-0636OC.